 |
|
Степень десульфуризации
Рациональный состав медно-пиритного
Концентрата
Химический состав концентрата: 15,7 % Cu, 33,6 % Fe, 6,8 % Zn, 39,4 % S, 0,7% SiO2 , 0,5% CaO, 2,0% Al2O3, 1,3 % прочие.
По минералогическому составу ориентировочно две трети меди находится в виде халькопирита, а одна треть – в виде ковеллина; цинк – в виде сфалерита и всё остальное железо – в виде пирита и пирротине.
1) Подсчитываем содержание халькопирита на 100 кг руды.
Меди в халькопирите,:
15,7 · 0,67 = 10,5 %
63,5 г Cuвходят в состав 183,5 г CuFeS2 .
10,5 кг Cu– Xкг CuFeS2 ,
X=  2
2
Зная количество и состав халькопирита, рассчитываем, сколько серы и железа связано в халькопирите.
Количество серы в халькопирите:
183,5 г CuFeS2 содержат 64,2 г S,
30,34 кг CuFeS2 – Xкг S,
X=  S
S
Количество железа в халькопирите:
183,5 г CuFeS2 содержат 55,8 г Fe,
30,34 кг CuFeS2– X кг Fe,
X=  Fe
Fe
Проверка: 10,5 + 10,6 + 9,22= 30,32 кг
2) Меди в ковеллине:
15,7 ·0,33 = 5,18 %
63,5 г Cu входят в 95,6 г CuS ,
5,18 кг Cu – в X кг , CuS
X= 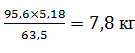 CuS
CuS
Количество серы в ковеллине:
95,6 г CuS содержат 32,1 г S ,
7,8 кг CuS – X кг S,
X=  S
S
Проверка: 5,18 + 2,16 = 7,34кг
Весь цинк содержится в виде сфалерита.
3) Количество сфалерита в концентрате:
65,4 г Zn входят в 97,5 г ZnS ,
6,8 кг Zn – в X кг ZnS ,
X=  кг ZnS
кг ZnS
Количество серы в сфалерите:
97,5 г ZnS содержат 32,1 г S ,
10,13 кг ZnS – X кг S ,
X=  S
S
Проверка: 6,8 + 3,33 = 10,13 кг
Железо и сера, кроме того, содержатся ещё в пирите и отсутствуют во всех других компонентах пустой породы, что даёт возможность определить по остатку количество железа и серы.
4) Количество железа в пирите и пирротине:
33,6 – 9,22 = 24,38 кг Fe
Количество серы в пирите:
39,4 – (10,6 + 2,16 + 3,33) = 22,86 кг S
FeS2 : a кг Fe
Fe7S8 : (24,38 – а) кг Fe
FeS2 :
55,8 г Fe – 64,2 г S
а - х
X= 
Fe7S8 :
7 × 55,8 г Fe – 8 × 32,1 г S
(24,38 – а ) - y
y = 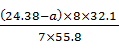 = 15,96 – 0,655 а
= 15,96 – 0,655 а
x + y = 22,86 кг
1,15 а + 15,96 – 0,655 а = 22,86 кг
0,495 а = 6,9
А = 13,96
Fe7S8 : 24,38 – 13,93 = 10,45 кг Fe
15,96 – 0,655 × 13,93 = 6,84 кг S
FeS2: 1,15 × 13,93 = 16,01 кг S
Таблица 1 – Рациональный состав медно-пиритного концентрата, %
| Компоненты | Минералы | Пустая порода | Всего | ||||
| CuFeS2 | CuS | ZnS | FeS2 | Fe7S8 | |||
| Cu | 10,5 | 5,18 | - | - | - | - | 15,68 |
| Fe | 9,22 | - | - | 13,93 | 10,45 | - | 33,6 |
| Zn | - | - | 6,8 | - | - | - | 6,8 |
| S | 10,6 | 2,16 | 3,33 | 16,01 | 6,84 | - | 39,4 |
| SiO2 | - | - | - | - | - | 0,7 | 0,7 |
| CaO | - | - | - | - | - | 0,5 | 0,5 |
| Al2O3 | - | - | - | - | - | 2,0 | 2,0 |
| Прочие | - | - | - | - | - | 1,3 | 1,3 |
| Итого : | 30,32 | 7,79 | 10,13 | 29,94 | 17,29 | 4,5 |
Степень десульфуризации
Десульфуризацию по реакциям сульфидов различных металлов с оксидами железа шихты мы подсчитать не можем, поэтому принимаем её, равной 5,0-15,0
% от оставшейся "твёрдой" серы.
В соответствии с данными таблицы 1 в 100 кг концентрата содержится 30,32 кг халькопирита. По реакции :
4CuFeS2 – 2Cu2S + 4FeS + S2 (1)
выделяется четвертая часть серы в парообразном состоянии:
10,6 : 4 = 2,65 кг S,
и образуется сульфида меди (I)
 кг Cu2S,
кг Cu2S,
в которых содержится 13,15 : 159,1 · 127,0 = 10,4 кг Cu
13,15 : 159,1 · 32,1 = 2,65 кг серы.
Образуется сернистого железа
 кг FeS ,
кг FeS ,
в которых содержится
14,5 : 87,9 · 55,8 = 9,2 кг Fe
14,5 : 87,9 · 32,1 = 5,3 кг S
Проверка : 2,65 + 10,02 + 13,15 = 30,3 кг CuFeS2
Пирита в концентрате 29,94 кг .
2FeS2 → 2FeS + S2 . (2)
В парообразном состоянии выделяется половина серы.
16,1 : 2 = 8 кг S
Пирротина в концентрате 17,29
Fe7S8 - 7FeS + ½ S2
В парообразном состоянии
6,84:8=0,85 кг S
Количество FeS:
13,93 + 8= 21,93 кг FeS
Проверка : 21,93+8 = 29,93 кг FeS2
Количество Fe7S8:
10,45+(6,84+0,85) = 16,44 кг FeS
Проверка : 16,44+0,85 = 17,29 кг Fe7S8
Ковеллина в концентрате 7,8 кг.
4CuS → 2Cu2S + S2 (3)
Выделяется половина серы в парообразном состоянии:
2,65 : 2 = 1,325 кг.
По таблице 1 определяем количество Cu2S :
5,18 + 1,325= 6,5 кг
Проверка : 1,325 + 6,5 = 7,8 кг CuS
Всего после разложения минералов и до начала их окисления (фактически оба эти процесса протекают одновременно и параллельно) образуется, кг:
Cu2S 13,15 + 6,5 = 19,65
FeS 14,5 + 21,93+16,44 = 52,87
S2 (пар) 2,65 + 1,325 + 8+,085 = 12,825
- степень десульфуризации:
Реакции взаимодействия дают 10% от «тв S2»
«тв S2» : исх. S2 - S2 (пар) = 39,4 – 12,825 = 26,575
ДS =  × 100% =
× 100% = 