 |
|
Питтинговая коррозия
К питтинговой коррозии склонно подавляющее большинство металлов (Fe, Ni, Со, Mn, Cr ,Ti, Al, Mg, Zr, Nb, Та, Cu, Zn и др.) и инструкционных материалов на их основе. Питтинговая коррозия возникает в морской воде, растворах солей, в охлаждающих системах холодильных машин, в системах оборотного водоснабжения химических предприятий. Термин «питтинг» применяют для описания как точечной коррозии, так и специфических коррозионных поражений (рисунок 3.1). Название питтинг обычно используют применительно к точечным поражениям [25].
В зависимости от условий формирования и развития (температура, кислотность, химический состав раствора) форма питтингов может быть различной. Питтинги бывают полусферические, цилиндрические, полиэдрические, открытые, закрытые и т.д. На внутренней поверхности питтингов сосуществуют области пассивного состояния и активного растворения. Для железа и никеля, например в кислых растворах разность между потенциалами дна питтинга и пассивной поверхности образца может достигать 1 В.

а) б) в)
а— х300; б– х1000; в — х8000
Рисунок 3.1 - Крупный питтинг на поверхности нержавеющей стали 03Х18Н11.
Полусферическую форму имеют так называемые полированные питтинги. Их внутренняя поверхность блестяща, что свидетельствует об изотропном, не зависящем от структуры, растворении, близком по механизму к электрополировке. Такие питтинги наблюдались на железе, нержавеющих сталях, алюминии, тантале, сплавах на основе никеля, титана, кобальта.
Ограненные (кристаллографические) питтинги и питтинги неправильной формы (анизотропно растущие в различно ориентированных зернах металла), как правило, являются травлеными. Они обнаружены на железе, углеродистых, низколегированных и нержавеющих сталях, никеле, алюминии, цинке, хроме. Форма кристаллографических питтингов соответствует правильным пирамидам, призмам и сложным многогранникам, как правило, ограниченным низкоиндексными плоскостями кристаллической решетки, а тип огранки определяется пустотами кристаллической решетки, образовавшимися на начальных стадиях зарождения питтингов.
Часто крупные (полусферические) питтинги возникают в результате слияния множества более мелких кристаллографических (рис. 3.1)
Для протекания питтинговой коррозии необходимо выполнепт ряда условий:
· питтинг образуется на поверхности металлов, находящихся и пассивном состоянии ;
· развитию питтинга способствуют дефекты пассивирующей и пленки (структурные неоднородности, посторонние включения, поры). Особенно уязвимы для питтинга ребра, риски, границы лакокрасочных покрытий;
· в растворе должны одновременно присутствовать активаторы питтинговой коррозии и пассиваторы металла.
Стимуляторами питтинговой коррозии металлов в водных средах являются ионы CI-, Br-, J-, CN-,  . Анионы-активаторы в тех или иных количествах присутствуют в подавляющем большинстве природных и технологических сред, в которых эксплуатируется металлическое оборудование и конструкции.
. Анионы-активаторы в тех или иных количествах присутствуют в подавляющем большинстве природных и технологических сред, в которых эксплуатируется металлическое оборудование и конструкции.
Относительная эффективность действия анионов-активаторов располагается в ряду С1-> Br- > J-. Однако в зависимости oт конкретных условий (температуры среды, концентрации аниона-активатора, природы металла) она может изменяться.
Основными требованиями к анионам-активатором должны быть их высокая адсорбируемость на поверхности металла и способность образовывать с компонентами металла растворимые комплексы.
Пассиваторами металла могут быть различные анионы, как правило, содержащие кислород (ОН-, NО3-, SO42-, СLO4- ), но наиболее универсальным пассиватором является вода. Образование питтингов протекает по электрохимическому механизму [25].
Электрохимическими критериями питтингостойкости металлов являются граничные потенциалы питтинговой коррозии — питтингообразования Епо, репассивации Ерп и критический потенциал Екр.
Потенциал питтингообразования Епо характеризует нарушение массивного состояния. Он является наименьшим потенциалом, при достижении которого начинается стабильный процесс образования питтингов.
Потенциал репассивации Ерп характеризует переход из области образования питтингов в пассивное состояние.
Для каждой конкретной системы металл/раствор существует определенный критический потенциал Екр, разграничивающий области устойчивого пассивного состояния (отрицательнее Екр) и области питтинговой коррозии (положительнее Екр). При сколь угодно долгом пребывании металла в области потенциалов отрицательнее Екр металл будет сохранять пассивное состояние, не подвергаясь питтинговой коррозии. При потенциалах положительнее Екр возможно возникновение ПК. Длительность пребывания металла в квазипассивном состоянии при потенциалах положительнее Екр будет определяться разностью между фактическим потенциалом металла Е и величиной Екр. Чем она больше, тем скорее произойдет нарушение пассивности и на поверхности металла разовьется питтинг, то есть тем меньше будет τинд.
Потенциалы Ерп и Екр практически не зависят от исходного состояния металлической поверхности (степени окисленности, шероховатости и т.д.). Их можно рассматривать как объективную характеристику коррозионной системы металл-раствор, определяемую физико-химическими параметрами обеих составляющих. Потенциал Епо, напротив, чувствителен к состоянию поверхности металла, условиям аэрации, небольшим колебаниям температуры и состава раствора, то есть не является объективной характеристикой питтингостойкости металла, но может служить косвенной характеристикой величины τинд.
Основными практическими критериями питтингостойкости металлических материалов являются базисы питтингостойкости ∆Епк, ∆Епо, и ∆Ерп, определяемые как разность между граничными потенциалами питтинговой коррозии (Епк, Епо, и Ерп) и потенциалом свободной коррозии Екор металла. Базисы питтингостойкости ∆Епк и ∆Ерп являются наиболее надежной характеристикой склонности металла к питтинговой коррозии. Чем они больше, тем меньше вероятность возникновения стабильных питтингов. Базис питтингостойкости ∆Епо является дополнительным [25].
Условия растворения металла в полости питтинга существенно отличаются от наблюдаемых на поверхности металла. Внутрипиттинговый раствор обогащен анионом-активатором, имеет пониженную, по сравнению с объемной, кислотность и, в ряде случаев, обезвожен. Это обеспечивается миграционным подводом анионов-активаторов, затрудненным диффузионным отводом продуктов растворения из полости питтинга и гидролизом солей растворяющихся металлов, протекающим по реакциям:

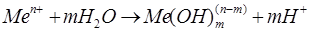
Константа равновесия реакции (3.1) равна:
 (3.1)
(3.1)
С другой стороны величину К можно определить из стандартной энергии Гиббса:
 (3.2)
(3.2)
Подставляя из (3.2) в (3.1) величину К, можно определить  - кислотность образующегося в питтинге раствора. Подробные расчеты носят оценочный характер, поскольку из-за высокой концентрации солей во внутрипиттинговом растворе использование коэффициентов активности возможно только с известной долей приближений
- кислотность образующегося в питтинге раствора. Подробные расчеты носят оценочный характер, поскольку из-за высокой концентрации солей во внутрипиттинговом растворе использование коэффициентов активности возможно только с известной долей приближений
рН внутрипиттингового раствора зависит от материала, подвергающегося питтинговой коррозии. Для сталей расчетные и измереные (путем замораживания и последующего определения рН) кислотности внутрипиттинговых растворов составляют от ~ 3,5 до 0. Такое различие определяется тем, что при растворении металла в питтинге на нержавеющей стали в раствор наряду с ионами Fe2+ переходят и ионы легирующих элементов — Nr2+, Сг3+, Мо3+, степень гидролиза которых выше, чем железа.
Основной причиной возникновения питтингов является дефектность (неоднородность) структуры реальных металлических материалов. Эффективность действия дефектов структуры металла как стимуляторов питтинговой коррозии различна и убывает в ряду: вторичные фазы > сегрегации примесей > дислокации > точечные дефекты. Среди вторичных фаз наиболее опасными промоторами питтинговой коррозии многих металлических конструкционных материалов являются сульфидные (оксидосульфидные) неметаллические включения. Облегчение зарождения питтингов сульфидными включениями вызвано ухудшением защитных свойств пассивирующей пленки, образующейся в местах их выхода на поверхность металла, и образованием микрощелей на границе металл/сульфидное включение [26].
Затруднение репассивации и увеличение скорости растворения металла в очаге локальной коррозии обусловлено накоплением в нем и его окрестностях высокоэффективных стимуляторов коррозии H2S и (или) HS-, образующихся при растворении сульфидного включения по реакциям:

Кроме того, при растворении сульфидных включений раствор в питтинге еще более подкисляется в соответствии с реакциями:

Термическая обработка и холодная деформация металлов могут оказывать влияние на их склонность к питтинговой коррозии вследствие изменения дефектности структуры, причем степень и направление влияния могут быть различными и зависят как от свойств самого металла, так и от конкретного типа его обработки. Так, например, слабые деформации могут приводить к росту склонности металлов к питтинговой коррозии вследствие повышения плотности дислокаций, появления линий скольжения и т.п., а сильные деформации, повышающие однородность его структуры, могут, напротив, способствовать увеличению питтингостойкости.
Интенсификацию питтинговой коррозии, как правило, вызывает рост температуры, однако интервалы ее наиболее сильного влиянии для материалов различной природы различны [26].
Увеличение концентрации аниона-активатора Сак (в рассматриваемом случае С1- и Вг-) при постоянной температуре также способствует смещению рассматриваемых потенциалов в отрицательном направлении. Последнее обнаружено для нержавеющих и углеродистых сталей.
Изменение рН раствора при постоянной величине Сак практически не влияет на величину Ерп. При определенной критической величине рН происходит изменение электрохимического состояния металла — реализуется возможность его самопассивации. В последнем случае (в средах от слабокислых до слабощелочных) Екор сталей также слабо зависит от рН раствора, то есть их базисы ∆Ерп и ∆Епк, а следовательно, и питтингостойкость, практически не зависят oт рН среды.
Изменение условий аэрации коррозионной среды оказывает влияние на питтингостойкость металлических материалов посредством изменения Екор за счет изменения скорости катодной реакции.
Наиболее существенное влияние на питтингостойкость сплавов оказывает их химический состав, что ярко проиллюстрировано на примере Fe и его сплавов. Введение в железо Cr, Ni, а также Ni и Мо соответственно в сплавы Fe-17Cr-Ni и Fe-17Cr-14Ni-Mo приводит к росту граничных потенциалов питтинговой коррозии. Для каждого из рассматриваемых элементов существует определенная область концентраций, в пределах которой легирование оказывает наиболее сильное влияние на питтингостойкость сплава [27].
Язвенная коррозия
Язвенная коррозия, как правило, протекает на поверхности активно растворяющихся металлов (в некоторых случаях коррозионные язвы могут образовываться и при слиянии питтингов, растущих на пассивном металле) и по характеру своего развития напоминает питтинговую коррозию, вследствие чего четкая квалификация локального коррозионного процесса часто бывает затруднена. Склонностью к язвенной коррозии обладают углеродистые и низколегированные стали, эксплуатирующиеся в водных хлоридсодержащих средах, например, водоводы, водопроводы, теплоэнергетическое оборудование.
Стойкость углеродистых и низколегированных сталей против язвенной коррозии в значительной степени зависит от их структурных и структурно-фазовых составляющих. Резкое снижение стойкости сталей против язвенной коррозии происходит при выделении в их структуре сульфидных неметаллических включений на основе кальция. Существенно меньшую и имеющую практическое значение только для углеродистых сталей опасность представляют включения сульфида марганца. Для сталей с феррито-перлитной структурой склонность к язвенной коррозии возрастает при образовании непрерывной сетки тонкодисперсных перлитных выделений.
Механизм действия сульфидов на основе кальция подобен описанному ранее для питтинговой коррозии нержавеющих сталей. Их более высокая, по сравнению с сульфидами марганца, коррозионная опасность объясняется более высокой скоростью растворения в электролитах [28].
Механизм действия перлитных фаз следующий. Перлит имеет слоистую пластинчатую структуру с соотношением толщин ферритной и цементитной пластинчатых фаз (7-8): 1. Толщина пластин в зависимости от условий термической обработки может меняться примерно в 10 раз, в частности для феррита — от 0,1 до 1,0 мкм, причем, чем тоньше пластины, тем более они искривлены. В нейтральных средах феррит растворяется на 1-2 порядка величины быстрее, чем цементит. С усилением кислотности раствора скорость растворения феррита возрастает еще на несколько порядков величины, а скорость растворения цементита если и изменяется, то не более чем в 10 раз.
При коррозии в нейтральном растворе локальная среда в микрозазоре, оставленном растворяющейся ферритной пластиной подкисляется, скорость растворения феррита еще более возрастает. Чем тоньше пластины в перлитовой колонии, тем быстpee закисляется среда в первых образовавшихся зазорах и тем выше скорость и, дальнейшего растворения ферритных пластин. Скорость же растворения феррита матрицы металла при этом будет оставаться неизменной. Потерявшие связь с металлом цементитные пластины выкрашиваются, образуя коррозионные язвы. Рассмотренный механизм имеет общие черты с питтинговой и щелевой коррозией, поскольку локальное подкисление раствора стимулирует коррозионный процесс. Видна общность с МКК, поскольку в обоих процессах происходит вытравление потерявшей связь с металлической матрицей карбидной фазы.