 |
|
Деякі властивості кисневмісних кислот галогенів
Таблиця 16
| Ступінь окислення галогенів | Формула гідроксиду | Кислотно-основні властивості | Назва кислоти | Назва солей |
| +1 | HClO | Слабка кислота | Гіпохлоритна (хлорнувата) | Гіпохлорити |
| HBrO | Слабка кислота | Гіпобромітна (бромнувата) | Гіпоброміти | |
| HIO | Амфотерні властивості | Гіпойодитна (йоднувата) | Гіпойодити | |
| +3 | HClO2 | Кислота середньої сили | Хлоритна (хлориста) | Хлорити |
| +5 | HClO3 | Сильна кислота | Хлоратна (хлорнувата) | Хлорати |
| HBrO3 | Сильна кислота | Броматна (бромнувата) | Бромати | |
| HIO3 | Кислота середньої сили | Йодатна (йоднувата) | Йодати | |
| +7 | HClO4 | Сильна кислота | Перхлоратна (хлорна) | Перхлорати |
| H5IO6 | Слабка кислота | Перйодатна (йодна) | Перйодати |
Всі кислоти добре розчиняються у воді. HClO4, HIO3, H5IO6 відомі у вільному стані, решта існує лише у розбавлених водних розчинах.
HClO i HBrO одержують дією кислот на гіпохлорити та гіпоброміти:
KClO + CO2 + H2O ® KHCO3 + HClO,
HГО3 (Г = Cl, Br, I) одержують окисленням галогенів сильними окисниками:
3I2 + 10HNO3 ® 6HIO3 + 10NO + 2H2O
або дією H2SO4 на хлорати, бромати, йодати:
NаIO3 + H2SO4 ® NaHSO4 + HIO3.
HClO4 та Н5ІО6 – дією H2SO4 на солі цих кислот:
KClO4 + H2SO4 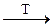 HClO4 + KHSO4;
HClO4 + KHSO4;
Ba5(IO6)2 + 5H2SO4 ® 5BaSO4$ + 2H5IO6.
HIO – слабкий амфотерний електроліт з переважно основними властивостями; Н5ІО6 – п’ятиосновна кислота, що утворює середні та кислі солі.
Кисневмісні кислоти галогенів нестійкі. HClO розкладається дією світла:
2HClO ® 2HCl + O2.
HClO4, HIO3, H5IO6 – при нагріванні:
4HClO4 ® 4ClO2 + 3O2 + 2H2O;
2HIO3 ® I2O5 + H2O.
Кисневмісні кислоти – сильні окисники. Їх окисна здатність зростає зі зниженням ступеню окислення та атомного номеру галогену:
5HClO + I2 + H2O ® 2HIO3 + 5HCl;
HClO3 + 5HCl ® 3Cl2 + 3H2O;
HIO3 + 5HI ® 3I2 + 3H2O.
Для НГО, HClO2, HClO3 характерне диспропорціювання:
3НГО ® 2НГ + НГО3;
4HClO2 ® HCl + HClO3 + 2ClO2 + H2O;
3HClO3 ® 2ClO2 + HClO4 + H2O.
Солі кисневмісних кислот МеГО одержують взаємодією галогенів з холодними розчинами лугів, соди, поташу:
Г2 + 2NaOH ® NaГО + NaГ + Н2О (Г=Cl, Br, I);
Cl2 + 2K2CO3 + H2O ® KClO + KCl + 2KHCO3;
солі МеГО3 одержують дією галогенів на гарячі розчини лугів:
3Г2 + 6КОН 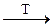 КГО3 + 5КГ + 3Н2О;
КГО3 + 5КГ + 3Н2О;
МeClO4 – помірним нагріванням відповідних хлоратів:
4KClO3 ® 3KClO4 + KCl;
Me5IO6 – окисленням йодатів хлором:
КІО3 + Cl2 + 6KOH ® K5IO6 + 2KCl + 3H2O.
Солі кисневмісних кислот галогенів більш стійкі, ніж відповідні кислоти. Їх стійкість зростає зі збільшенням ступеню окислення галогенів. Так, гіпохлорити та хлорити нестійкі, диспропорціонують у розчинах за звичайних умов:
3МеClО ® МеClО3 + 2МеCl.
Хлорати і перхлорати розкладаються при нагріванні:
4KClO3 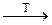 3KClO4 + KCl;
3KClO4 + KCl;
2KClO3 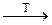 2KCl + 3O2;
2KCl + 3O2;
KClO4 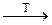 KCl + 2O2.
KCl + 2O2.
Окисні властивості солей збільшуються зі зменшенням ступеню окислення галогенів. Солі НГО – сильні окисники у будь-якому середовищі:
CaOCl2 + 2НCl ® CaCl2 + Cl2 + H2O;
NaClO+2KI+H2O®NaCl+I2+2KOH;
MeГО3 – сильні окисники тільки у кислому середовищі та при нагріванні:
NaClO3 + 6KI + 3H2SO4 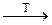 NaCl + 3I2 + 3K2SO4 + 3H2O;
NaCl + 3I2 + 3K2SO4 + 3H2O;
MeClO4 у розчинах не проявляють окисних властивостей.
Лабораторна робота