 |
|
Сполуки з іншими елементами
Елементи групи 1В
1В групу складають елементи 29Сu, 47Ag, 79Au. Будова зовнішніх електронних шарів атомів:
↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑ - - - , де n (номер періоду) = 4,5,6 відповідно.
( n – 1 ) d ns np
Фізичні характеристики елементів
Деякі важливі дані про d – елементи 1В групи наведені в таблиці 1.
Таблиця 1
| Елемент | Сu | Ag | Au |
| Ковалентний радіус атома, нм | 0,117 | 0,134 | 0,134 |
| Радіус іону, нм, Е+ Е²+ Е³+ | 0,077 0,073 0,054 | 0,115 0,094 0,075 | 0,137 – 0,085 |
| Основна форма існування за звичайних умов | Червоно-коричневий метал | Білий або світло-сірий метал | Жовтий метал |
| Густина, г/см³, 298К | 8,96 | 10,49 | 19,30 |
| Температура плавлення, °С | 1083,0 | 960,3 | 1064,2 |
| Перший потенціал іонізації, В | 7,73 | 7,58 | 9,23 |
| Спорідненість до електрону, еВ | 1,8 | 1,3 | 2,31 |
| Електронегативність | 1,75 | 1,42 | 1,42 |
| Ступені окиснення елемента в сполуках (найбільш характерні виділені) | +1 +2 +3 | +1 +2 +3 | +1 +3 |
В таблиці 2 наведені основні відомості про d – елементи 1В групи.
Таблиця 2
| Символ елемента | Cu | Ag | Au |
| Українська назва | Мідь | Срібло | Золото |
| Російська назва | Медь | Серебро | Золото |
| Латинська назва | Cuprum | Argentum | Aurum |
| Рік відкриття | Відома з давніх давен | Відоме з давніх давен | Відоме з давніх давен |
| Автор відкриття | – | – | – |
| Вміст в земній корі, масова частка, % | 0,01 | 10‾5 | 10‾7 |
| Основні природні сполуки | Самородна мідь, мінерали CuFeS2, Cu2S, Cu2(OH)2CO3 | Самородне срібло, мінерали Ag2S, Ag3SbS3, Ag3AgS3 | Зустрічається переважно у самородному стані; в мінералах AuTe2, (AuAg)Te, (AgAu)Te2 |
| Вміст в організмі людини, масова частка, % | 10‾4 | 10‾6 | 10‾6 |
| Місце найбільшого накопичення в організмі людини | Печінка, кістки, головний мозок | Печінка, нирки, кістки, залози внутрішньої секреції | Печінка, нирки, кістки |
| Символ елемента | Cu | Ag | Au |
| Біологічна роль | Бере участь у ферментному окисненні, тканинному диханні, імунних процесах, пігментації. Є компонентом багатьох ферментних систем, активує деякі гормони. Сприяє синтезові білку, впливає на білковий обмін. | Інактивує певні ділянки молекул ферментів. | Є інгібітором багатьох ферментних систем. |
| Найважливіші фармацевтичні препарати | CuSO4 – антисептичний, в´яжучий, блювотний засіб; “ІМ” – для профілактики та лікування ендемічного зобу; CuO, Cu2O - як складова частина цементів, пломб у стоматології. | AgNO3 – бактерицидний, протизапальний, припікаючий засіб; AgCl – складова частина стоматологічних цементів, пломб; Ag, колоїдне срібло – бактерицидний засіб. | AuNaS2O3 – при лікуванні туберку-льозу, сифілісу; Na3[Au(S2O3)2] – при лікуванні ревматоїдного артриту; Au, колоїдне золото – антисептик; 198Au для лікування злоякісних пухлин та хронічних лейкозів. |
1.2. Прості речовини
Чорнову мідь ( 95 – 98 % Сu) одержують із природних руд, використовуючи пірометалургійний та гідрометалургійний методи. Основним є пірометалургійний, який схематично можна записати рівнянням:
2СuFeS2 + 5O2 + 2SiO2 → 2Cu + 2FeSiO3 + 4SO2.
За гідрометалургійним методом руду розчиняють у розбавлених розчинах H2SO4, NH3 чи Fe2(SO4)3, наприклад, за схемою:
Cu2S + 2Fe2(SO4)3 → 4FeSO4 + 2CuSO4 + S.
Із одержаного розчину металічну мідь витісняють залізом або виділяють електролізом. Високочисту мідь одержують електролітично з чорнової. Срібло одержують в результаті комплексної переробки поліметалічних руд. Для видобування золота із золотоносних порід застосовують ціанідний метод, який базується на розчиненні золота у розчині NaCN:
4Au + 8NaCN + O2 + 2H2O → 4Na[Au(CN)2] + 4NaOH
з подальшим витісненням золота цинком:
2Na[Au(CN)2] + Zn → Na2[Zn(CN)4] + 2Au
або промиванням водою та розчиненням золота у ртуті з подальшою перегонкою амальгами.
Хімічна активність Сu, Ag, Au незначна і в ряду Cu – Au зменшується. Найлегше ці метали взаємодіють з галогенами:
Сu + Г2 → СuГ2 (Г = F, Cl, Br);
2Cu + I2 → 2CuI;
2Ag + Г2 → 2AgГ ( Г = Cl, Br, I);
Ag + F2 → AgF2;
2Au + 3Г2 → 2AuГ3 (Г = F, Cl, Br);
2Au + I2 → 2AuI.
Мідь і срібло взаємодіють з сіркою:
2Ag + S  Ag2S;
Ag2S;
Cu + S  CuS.
CuS.
З киснем при нагріванні взаємодіє тільки мідь:
2Сu + O2  2CuO;
2CuO;
4Сu + O2  2Cu2O.
2Cu2O.
У вологому повітрі мідь повільно покривається плівкою зеленого (СuOH)2CО3:
2Cu + H2O + CO2 → (СuOH)2CО3.
У присутності H2S срібло на повітрі покривається плівкою чорного Ag2S:
4Ag + O2 + 2H2S → 2Ag2S + 2H2O.
Cu та Ag реагують з концентрованою сірчаною кислотою:
Сu + 2H2SO4(конц)  СuSO4 + SO2 + 2H2O,
СuSO4 + SO2 + 2H2O,
та з азотною кислотою:
Cu + 4HNO3(конц.)  Cu(NO3)2 + 2NO2 + 2H2O;
Cu(NO3)2 + 2NO2 + 2H2O;
3Cu + 8HNO3(розб.)  3Cu(NO3)2 + 2NO + 4H2O;
3Cu(NO3)2 + 2NO + 4H2O;
Ag + 2HNO3(конц.)  AgNO3 + NO2 + H2O.
AgNO3 + NO2 + H2O.
Найкращим розчинником для золота є насичений хлором розчин НСl та “царська горілка” (HNO3(конц.) + 3HCl(конц.)):
2Au + 3Cl2 + 2HCl → 2H[AuCl4];
Au + HNO3 + 4HCl → H[AuCl4] + NO + 2H2O.
Au розчиняється також у концентрованій H2SeO4 за температури вище 130ºС:
2Au + 7H2SeO4 → 2H[Au(SeO4)2] + 3SeO2 + 6H2O.
По відношенню до лугів за відсутності окисників Cu, Ag, Au стійкі.
Для них характерні реакції комплексоутворення:
4Cu + 8NaCN + O2 + 2H2O → 4Na[Cu(CN)2] + 4NaOH;
4Ag + 8NaCN + O2 + 2H2O → 4Na[Ag(CN)2] + 4NaOH;
2Cu + 8NH3 + O2 + 2H2O → 2[Cu(NH3)4](OH)2.
Cu та Ag проявляють високу каталітичну активність.
Бінарні сполуки
В бінарних сполуках елементи 1В групи проявляють ступені окиснення +1, +2, +3. Сполуки вищих ступенів окиснення забарвлені.
Сполуки з воднем
Відомий гідрид міді ( I ) CuH – кристалічна речовина червоно-бурого кольору, яку одержують дією алюмогідриду літію на CuI в ефірному розчині:
4CuI + LiAlH4 → 4CuH + LiI + AlI3.
Гідрид міді (I) нестійкий:
2CuH  2Cu + H2;
2Cu + H2;
4CuH + 3О2  4CuO + 2H2O.
4CuO + 2H2O.
Галогеніди
Відомі такі галогеніди елементів 1В групи:
CuГ ( Г = F, Cl, Br, I ): CuF2, CuCl2, CuBr2, CuF3;
AgГ ( Г = F, Cl, Br, I ): AgF2, AgF3;
AuCl, AuBr, AuI, AuГ3 ( Г = F, Cl, Br, I).
Всі галогеніди за звичайних умов тверді, кристалічні речовини, погано розчиняються у воді (крім AgF, CuF2, AuF3 та AuI3). CuГ2 (крім CuI2) більш стійкі, ніж CuГ. CuI2 розкладається при утворенні у водних розчинах:
2CuSO4 + 4KI → CuI↓ +I2 + 2K2SO4.
Термічно нестійкими є галогеніди Аu, фториди Cu (III) та Ag (III).
Більшість галогенідів схильна до комплексоутворення з галогеноводневими кислотами, галогенідами, а деякі галогеніди Е (I) – також і з іонами S2O3²ˉ та CN‾ :
CuГ + HГ(конц.)  Н[CuГ2], ( Г = F, Cl, Br, I ),
Н[CuГ2], ( Г = F, Cl, Br, I ),
CuCl + 2NH3 → [Cu(NH3)2]Cl;
CuГ2 + 2NaГ(конц.) → Na2[CuГ4];
CuCl2 + 4NH3 → [Cu(NH3)4]Cl2;
AgГ + 2NH3 → [Ag(NH3)2]Г, крім АgI;
AgГ + 2Na2S2O3 → Na3[Ag(S2O3)2] + NaГ;
AuCl + 2NH3(p) → [Au(NH3)2]Cl;
AuBr + NaBr(конц.)  Na[AuBr2];
Na[AuBr2];
AuCl3 + HCl → H[AuCl4].
Особлива схильність AuCl3 до утворення аніонного комплексу проявляється і при взаємодії з водою з утворенням розчину гідроксотрихлорозолотої (III) кислоти:
AuCl3 + H2O → H[AuCl3(OH)].
H[AuCl4] – сильний окисник. Реакцію:
H[AuCl4] + 3FeSO4 → Au + Fe2(SO4)3 + FeCl3 + HCl
застосовують в аналітичній хімії.
Комплекс [AuCl2]  – нестійкий, він диспропорціонує на Au0 та Au+3:
– нестійкий, він диспропорціонує на Au0 та Au+3:
3AuCl + KCl → 2Au + K[AuCl4].
Галогеніди Cu(I) та Au(I) з легкістю окиснюються киснем повітря:
4CuCl + O2 + 4HCl → 4CuCl2 + 2H2O.
Галогеніди Ag(I) чутливі до дії світла:
2AgBr  2Ag +Br2.
2Ag +Br2.
Оксиди
Елементи IВ групи утворюють такі оксиди: Cu2O, CuO, Cu2O3, Ag2O, AgO, Ag2O3, Au2O3. Всі оксиди тверді, забарвлені сполуки, практично нерозчинні у воді. Оксиди Ag, Au та Cu2O3 - нестійкі.
2Ag2O  4Ag + O2;
4Ag + O2;
2Au2O3  4Au + 3O2.
4Au + 3O2.
AgO – змішаний оксид – Ag+1Ag+3O2.
CuO одержують:
– термічним розкладом основного карбонату, нітрату чи гідроксиду Cu(II):
(CuOH)2CO3  2CuO + CO2 + H2O;
2CuO + CO2 + H2O;
2Cu(NO3)2  2CuO + 4NO2 + O2;
2CuO + 4NO2 + O2;
Cu(OH)2  CuO + H2O;
CuO + H2O;
– окисненням міді при нагріванні:
2Cu + O2  2CuO.
2CuO.
Ag2O – за реакцією:
2AgNO3 + 2NaOH → Ag2O↓ + 2NaNO3 + H2O
Au2O3 – за реакцією:
2Au(OH)3  Au2O3 + 3H2O.
Au2O3 + 3H2O.
Ag2O – основний оксид; оксиди міді та золота проявляють амфотерні властивості: Cu2O i CuO мають сильно виражені основні властивості, а Au2O3 - переважно кислотні. При взаємодії з лугами вони утворюють купрати та гідроксоаурати. З надлишком галогеноводневих кислот – галогенідні комплекси:
Ag2O + 2HNO3 → 2AgNO3 + H2O;
Cu2O + 4HCl → 2H[CuCl2] + H2O;
CuO + 2HCl(конц.) → CuCl2 + H2O;
Ag2O + 4HCl(конц., надл.) → 2H[AgCl2] + H2O;
CuO + 4HCl(конц., надл.) → H2[CuCl4] + H2O;
CuO + 2NaOH  Na2CuO2 + H2O;
Na2CuO2 + H2O;
Au2O3 + 2NaOH + 3H2O  2Na[Au(OH)4];
2Na[Au(OH)4];
Au2O3 + 8HCl(конц., надл.) → 2H[AuCl4] + 3H2O.
Оксиди Е (І) і СuО легко розчиняються у водному розчині NH3 :
Cu2O + 4NH3 + H2O → 2[Cu(NH3)2]OH
CuO + 4NH3 + H2O → [Cu(NH3)4](OH)2
Ag2O + 4NH3 + H2O → 2[Ag(NH3)2]OH.
[Ag(NH3)2OH] при зберіганні перетворюється у вибухонебезпечний імід срібла:
2[Ag(NH3)2OH] → Ag2NH + 3NH3 + 2H2O.
CuO – розчиняється у склі, емалях, надаючи їм зелено-синього забарвлення.
Cu2O, CuO, Ag2O – проявляють властивості окисників:
Cu2O + Н2 → 2Cu + H2O;
3CuO + 2Al → 3Cu + Al2O3;
Ag2O + HCOH → HCOOH + 2Ag;
Внаслідок відновлення аміачних комплексів Ag(І) альдегідами, глюкозою тощо Ag виділяється у вигляді блискучого осаду, який міцно закріплюється на поверхні скла.
Сполуки з іншими елементами
Відомі сульфіди Cu(I), Cu(II), Ag(I), Au(I,III).
Cu2S oдержують взаємодією міді з сіркою при нагріванні, інші сульфіди – за реакціями обміну.
Сульфіди міді розчиняються у полісульфідах лужних металів та амонію, а також в HNO3; сульфіди срібла та золота – в сульфідах лужних металів:
3CuS + 8HNO3 → 3CuSO4 + 8NO + 4H2O;
Ag2S + Na2S → 2Na[AgS] або Na3[AgS2];
Au2S + 3Na2S → 2Na3[AuS2];
Au2S3 + 5Na2S → 2Na3[AuS2] + 2Na2S2.
Вологий CuS окиснюється киснем повітря:
CuS + 2O2  CuSO4.
CuSO4.
Прожарюванням CuS відновлюється до сульфіду міді (І):
2CuS 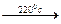 Cu2S + S.
Cu2S + S.