 |
|
Сполуки з іншими елементами
Мn, Тс та Rе утворюють безпосередньо чи непрямим шляхом з Si, N, P, As, B, S багаточисельні сполуки, тверді речовини, як правило, нестехіометричного складу, практично не розчинні у воді.
Гідроксиди та їх похідні
Гідроксиди та іони солей, що їм відповідають, наведені в таблиці 9.
Таблиця 9
| Ступінь окис- нення елемента | Елемент | |||||||||
| Mn | Tc | Re | ||||||||
| гідроксиди | іони | гідрок-сиди | іони | гідроксиди | іони | |||||
| +2 | Mn(OH)2 | Mn2+ | – | – | ReO∙H2O | Re2+ | ||||
| Ступінь окис-нення елемента | Елемент | |||||||||
| Mn | Tc | Re | ||||||||
| гідроксиди | іони | гідрок-сиди | іони | гідроксиди | іони | |||||
| +3 | Mn(OH)3 | Mn3+ | – | – | Re2O3∙nH2O | Re3+ | ||||
| +4 | MnO2∙H2O | Mn4+, MnO32– (манганіт) | – | Tc4+ | ReO2∙nH2O | Re4+, ReO32- (реніт) | ||||
| +5 | – | MnO43– (гіпоманганат) | – | – | – | ReO3‾ (гіпоренат) | ||||
| +6 | H2MnO4 | MnO42– (манганат) | – | – | H2ReO4 | ReO42‾ (ренат) | ||||
| +7 | HMnO4 | MnO4– (перманганат) | HTcO4 | TcO4‾(пертехнат) | HReO4 | ReO4‾ (перренат) | ||||
Зі збільшенням ступеню окиснення елементів хімічний характер гідроксидів змінюється від типового основного до типового кислотного. При цьому елементи можуть входити до складу солей і як катіони, і як аніони відповідних кислот.
Гідроксиди, що відповідають ступеням окиснення елементів +2, +3, +4, є малорозчинними осадами, часто змінного складу, основного характеру, а гідроксиди, що відповідають ступеням окиснення елементів +6, +7, – типові кислоти, добре розчинні у воді.
Кислоти Н2ЕО4 нестійкі:
2H2MnO4 → 2MnO2 + 2H2O + O2.
У водному розчині диспропорціонують:
3H2MnO4 → MnO2 + 2HMnO4 + 2H2O.
Солі Н2МnО4 – манганати – одержують, сплавляючи МnО2 з лугами в присутності кисню чи інших окисників:
2MnO2 + 4KOH + O2 → 2K2MnO4 + 2H2O;
MnO2 + 2KOH + KNO3 → K2MnO4 + KNO2 + H2O;
3MnO2 + 6KOH + KClO3 → 3K2MnO4 + KCl + 3H2O.
Манганати стійкі тільки в лужному середовищі. При нагріванні, під дією розбавлених кислот чи води вони розкладаються:
3K2MnO4  2K3MnO4 + MnO2 + O2;
2K3MnO4 + MnO2 + O2;
3K2MnO4 + 2H2O  2KMnO4 + MnO2 + 4KOH;
2KMnO4 + MnO2 + 4KOH;
3K2MnO4 + 4CH3COOH → 2KMnO4 + H2MnO3 + 4KCH3COO + H2O;
3K2MnO4 + 4HNO3 → 2KMnO4 + MnO2 + 4KNO3 + 2H2O;
12K2MnO4 + 8CO2  8KMnO4 + 8K2CO3 + 2Mn2O3 + O2.
8KMnO4 + 8K2CO3 + 2Mn2O3 + O2.
Кислоти НЕО4 - більш стійкі, але у вільному стані виділена тільки технецієва кислота НТсО4. НЕО4 – сильні кислоти.
Перманганати – стійкі сполуки, при нагріванні розкладаються:
2KMnO4  K2MnO4 + MnO2 + 3O2
K2MnO4 + MnO2 + 3O2
4KMnO4 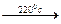 2K2MnO3 + 2MnO2 + 3O2.
2K2MnO3 + 2MnO2 + 3O2.
У водних, розчинах є сильними окисниками, продукти відновлення яких визначаються реакцією середовища:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
2KMnO4 + 3Na2SO3 + H2O → 2MnO2 + 3Na2SO4 + 2KOH
2KMnO4 + Na2SO3 + 2NaOH → K2MnO4 + Na2MnO4 + Na2SO4 + H2O.
сильно кисле середовище Мn2+

 безбарвний
безбарвний
слабкокисле, нейтральне, MnO2
MnO4¯ + відновник слабколужне середовище бурий
фіолетовий
MnO42‾
сильно лужне середовище зелений
Солі Мn2+ у кислому та нейтральному середовищі стійкі проти дії таких окисників як Cl2, Br2, O2, але окиснюються сильнішими окисниками:
MnSO4 + O3 + H2O → MnO2 + H2SO4 + O2;
2MnSO4 + 5PbO2 + 6HNO3 → 2HMnO4 + 3Pb(NO3)2 + 2PbSO4 + 2H2O;
3MnSO4 + 2KMnO4 + 2H2O → 5MnO2 + K2SO4 + 2H2SO4.
Для Мn2+ комплексоутворення менш характерне, ніж для іонів інших d-елементів, що пояснюється електронною будовою d5 іона Мn2+ .
У водних розчинах утворюється аквакомплекс [Mn(H2O)6]2+. Відомі нестійкі ціанідні [Mn(CN)6]4‾ та галогенідні комплекси [MnГ6]4‾.
Існує стійкий димер пентакарбонілу мангану Mn2(CO)10, який реагує з лугами, утворюючи солі аніону [Mn(CO)5]–:
0 –1
13Mn2(CO)10 + 40NaOH → 2MnCO3 + 8Na2CO3 + 24Na[Mn(CO)5] + 20H2O.
Лабораторна робота
Дослід 1. Одержання гідроксиду мангану (ІІ) та окиснення його
киснем повітря
Внести у пробірку 3 - 4 краплини розчину солі мангану (ІІ) та 2 – 3 краплини розчину лугу. Якого кольору осад гідроксиду мангану (ІІ) ?
Розмішати осад скляною паличкою. Внаслідок чого спостерігається побуріння осаду ? Написати рівняння відповідних реакцій.
Дослід 2. Окисні та відновні властивості оксиду мангану (IV)
а) Окисна властивість.
У пробірку внести 1 мікрошпатель оксиду мангану (IV) та додати 2 - 3 краплини концетрованої соляної кислоти. Спостерігати виділення газоподібної речовини. Який газ виділяється? Якщо реакція проходить недостатньо швидко, то слід підігріти пробірку на полум’ї.
Написати відповідне рівняння окисно-відновної реакції.
б) Відновна властивість.
У пробірку внести 1 мікрошпатель оксиду мангану (IV) та додати 2 – 3 краплини концентрованого розчину гідроксиду калію, а також внести 1 мікрошпатель кристалічного нітрату калію. Суміш нагріти. Який колір одержаного розчину?
Написати відповідне рівняння окисно-відновної реакції.
Дослід 3. Розклад перманганату калію при нагріванні.
У пробірку внести 3 - 4 кристалика перманганату калію та нагріти на невеликому полум’ї до повного його розкладу на диоксид мангану, манганат калію та кисень. Після охолодження пробірки до сухого залишку додати 5 - 6 краплин води. Який колір набуває одержаний розчин? Яка сполука знаходиться в осаді? Написати рівняння реакцій.
Дослід 4. Відновлення перманганату калію сульфітом натрію в різних
середовищах
У три пробірки внести по 3 - 5 краплин розчину перманганату калію. Додати в першу пробірку 2 - 3 краплини розчину сірчаної кислоти, а потім 3 - 4 краплини розчину сульфіту натрію; у другу пробірку - 3 - 4 краплини розчину сульфіту натрію; в третю - 3 - 4 краплини розчину гідроксиду натрію, а потім 3 - 4 краплини розчину сульфіту натрію.
Написати рівняння окисно-відновних реакцій.
Вправи
1. Які кислотно-основні та окисно-відновні властивості мають оксиди мангану MnO, Mn3O4, MnO2, Mn2O7? Як можна отримати ці сполуки? Навести рівняння реакцій, що ілюструють відповідь.
2. Закінчити рівняння реакцій:
Mn(CN)2 + KCN →
MnSO4 + KMnO4 + КОH →
MnO2 + KClO3 + KOH →
3. Яку сполуку мангану широко використовують у медицині та лабораторіях? Завдяки яким властивостям? Як поводить себе ця сполука, реагуючи з Na2SO3 у середовищах з різним значенням рН? Написати рівняння відповідних реакцій.
4. Яка найважливіша природна сполука мангану? Як вилучити манган з руд? Коротко охарактеризувати хімічні властивості мангану. Навести по одній формулі сполук для всіх ступенів окиснення, що проявляє манган.
5. Закінчити рівняння реакцій та вказати окисник та відновник:
KMnO4 + K2SO3 + KOH →
KMnO4 + K2SO3 + H2O →
K2MnO4 + Cl2 →
6. Скласти рівняння реакцій, що відбуваються під час перетворень:
Mn → MnCl2 → Mn(OH)4 → MnO2 → KMnO4
7. Яка сполука мангану називається манганатом? Написати рівняння реакцій утворення манганату калію:
MnO2 + O2 + KOH →
MnO2 + KNO3 + KOH →
MnO2 + KClO3 + KOH →
8. Як змінюються кислотно-основні властивості оксидів мангану при переході від MnO до Mn2O7? Чим це можна пояснити?
9. Які властивості мангану у ступені окиснення +7 використовують з медичною та лабораторною метою? Як поводить себе окисник перманганат калію у середовищах з різними значеннями рН? Навести приклади.