 |
|
Уравнение Ван-дер-Ваальса
Описание свойств реального газа можно осуществить, написав уравнение состояния, связывающее между собой макроскопические параметры Р, V и T. Оно может быть получено путем изменения уравнения Клапейрона-Менделеева с учетом реальных сил взаимодействия между молекулами:
 - для одного моля.
- для одного моля.
1) Необходимо принять во внимание существование сил отталкивания между молекулами или, что тоже самое, собственного объема молекул. Учет этого приводит к уменьшению свободного объема на некоторую величину «b». Расчеты показывают, что  , где
, где  - собственный объем молекул. Эта поправка «b» для каждого газа имеет свое значение. При увеличении температуры величина «b» уменьшается.
- собственный объем молекул. Эта поправка «b» для каждого газа имеет свое значение. При увеличении температуры величина «b» уменьшается.
2) Следует учесть силы притяжения между молекулами газа, которые вызывают уменьшение давления молекул на стенки сосуда на величину  . Давление, которое испытывает пристенный слой со стороны молекул газа, равно силе, действующей на все молекулы на единице поверхностного слоя. Молекулы, находящиеся в пристенном слое газа (их концентрация «n» обратно пропорциональна объему газа V), притягиваются ближайшими молекулами внутри газа (их концентрация «n» также обратно пропорциональна V). Следовательно:
. Давление, которое испытывает пристенный слой со стороны молекул газа, равно силе, действующей на все молекулы на единице поверхностного слоя. Молекулы, находящиеся в пристенном слое газа (их концентрация «n» обратно пропорциональна объему газа V), притягиваются ближайшими молекулами внутри газа (их концентрация «n» также обратно пропорциональна V). Следовательно:
 – постоянная, зависящая от природы газа.
– постоянная, зависящая от природы газа.
Учитывая обе поправки, запишем уравнение состояния реального газа, носящего имя Ван-дер-Ваальса, впервые получившего его в 1873 г.:

Из этого уравнения следует, что давление реального газа может обратиться в нуль. Это означает, что при достаточном охлаждении и сжатии газ может превратиться в жидкость, а затем и затвердеть, приобретя вполне определенный объем. Это важное следствие уравнения Ван-дер-Ваальса полностью подтверждено экспериментально: все известные газообразные вещества могут быть переведены в жидкое, а затем при дальнейшем охлаждении и в твердое состояние. Перепишем уравнение Ван-дер-Ваальса:

Это уравнение записано для 1 моля. Для  молей:
молей:

Уравнение Ван-дер-Ваальса в основном правильно описывает свойства реальных газов в достаточно большом интервале температур и давлений. Вместе с тем в поведении реальных газов существуют и отступления от этого уравнения. Эти расхождения привели к попыткам описания состояния реального газа другими уравнениями, также не свободными от недостатков. В последнее время состояние реального газа описывают уравнением, представляющим разложение давления по степеням 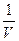 :
:
