 |
|
Экспериментальное подтверждение молекулярно-кинетической теории газов (опыт Штерна)
 В 1920 г. Штерн поставил опыт, с помощью которого можно было непосредственно проверить теорию распределения молекул по скоростям и измерить скорость теплового движения молекул. Суть опыта поясняется рис.11.5.
В 1920 г. Штерн поставил опыт, с помощью которого можно было непосредственно проверить теорию распределения молекул по скоростям и измерить скорость теплового движения молекул. Суть опыта поясняется рис.11.5.
Два коаксиальных цилиндра вращаются как единое целое с угловой скоростью w. По оси натянута платиновая проволока, покрытая тонким слоем серебра. Провод нагревается электрическим током. Температура проводки измеряется по ее электрическому сопротивлению. При температуре t = 12000С атомы серебра испаряются и разлетаются по всем направлениям. Через узкую щель, прорезанную во внутреннем цилиндре, вылетает пучок атомов серебра, скорость которых направлена вдоль радиусов.
Пока атом, летящий со скоростью v, проходит расстояние между цилиндрами l, цилиндры успевают повернуться на угол Dj, 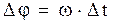 , но
, но  , следовательно,
, следовательно,
 , при l » R.
, при l » R.
Откуда
 ,
,
где DS – расстояние по окружности внешнего цилиндра от конца радиуса, проведенного через отверстие (через границу щели).
Вычисленные по результатам эксперимента значения скорости оказались близки к теоретическим результатам; кроме того, профиль сечения слоя серебра, как показано на рисунке, весьма точно соответствует распределению Максвелла молекул по скоростям. Теория получила хорошее подтверждение на опыте.
Лекция 12. Некоторые вопросы статистической физики
Распределение энергии по степеням свободы. Вероятность и флюктуации. Распределение молекул /частиц/ по абсолютным значениям скорости. Распределение Максвелла. Скорости теплового движения частиц. Средняя длина свободного пробега молекул. Распределение Больцмана. Барометрическая формула. Внутренняя энергия и теплоемкости идеального газа. Классическая теория теплоемкостей.
12.1. Распределение энергии по степеням свободы
Выражение для средней энергии молекулы газа  учитывает только её среднюю энергию поступательного движения. Но наряду с поступательным движением, молекула может вращаться и совершать колебания. Эти виды движения так же связаны с некоторым запасом энергии, определить который, можно пользуясь понятием статистической физики о равном распределении энергии по степеням свободы.
учитывает только её среднюю энергию поступательного движения. Но наряду с поступательным движением, молекула может вращаться и совершать колебания. Эти виды движения так же связаны с некоторым запасом энергии, определить который, можно пользуясь понятием статистической физики о равном распределении энергии по степеням свободы.
Число независимых координат, необходимых для полного описания положения системы в пространстве, называется числом степеней свободы (i).
Так, например, движение точки, совершающей перемещение по всей области пространства в любой момент времени будет полностью описано тремя координатами, т. е. она обладает тремя степенями свободы (i=3).
Если на характер изучаемого движения накладывать некоторые ограничения, то число степеней свободы уменьшается.
Так для описания движения точки по поверхности необходимо задать две независимые координаты, т.е. движущаяся по поверхности точка имеет две степени свободы (i = 2).
Точка, совершающая движение по прямой, имеет одну степень свободы (i = 1). В общем случае точка или система точек наряду с поступательным движением может одновременно участвовать во вращательном и колебательном движениях. Общее число степеней свободы в этом случае будет равно
 (12.1)
(12.1)
где iп - число степеней свободы поступательного движения точки;
iвр - число степеней свободы вращательного движения точки;
iк - число степеней свободы колебательного движения точки (  );
);
iкп - число степеней свободы колебаний точки при поступательном движении;
iквр - число степеней свободы колебаний точки при вращательном движении.
По аналогии с механическими системами, каждой молекуле, каждому атому газа можно приписать определённое число степеней свободы, рассматривая при этом их как материальные точки. Так, одноатомная молекула газа имеет только три степени свободы поступательного движения (i = 3); двухатомная при упругой связи – шесть степеней свободы (i = 6), а при жёсткой связи - пять степеней свободы (i = 5); трёхатомная молекула при жёсткой связи между атомами имеет шесть степеней свободы (i = 6).
Известно, что средняя кинетическая энергия поступательного движения молекул равна 
Поступательное движение описывается тремя степенями свободы, а т.к. все степени свободы равноправны, то на каждую из них приходится
 (12.2)
(12.2)
Но ни один из видов движения (поступательное, вращательное, колебательное) не имеет преимуществ перед другими. Следовательно, можно утверждать: «На любую степень свободы приходится в среднем одинаковая энергия, а молекула, обладающая i степенями свободы, будет обладать энергией  ». Данное утверждение называют теоремой о равномерном распределении энергии по степеням свободы (теорема Больцмана).
». Данное утверждение называют теоремой о равномерном распределении энергии по степеням свободы (теорема Больцмана).
Вероятность и флюктуации. Распределение молекул (частиц) по абсолютным значениям скорости. Распределение Максвелла. Скорости теплового движения частиц. Средняя длина свободного пробега молекул
Статистическая физика это раздел молекулярной физики, в котором изучаются свойства и движения не отдельных молекул (частиц), а совокупности частиц, характеризующиеся средними величинами.
Статистические закономерности - количественные закономерности, устанавливаемые статистическим методом, в котором рассматриваются лишь средние значения величин, характеризующих данную совокупность молекул (рассматривается конкретная молекулярная модель и к ней, применяются математические методы статистики, основанные на теории вероятностей).
Одними из основных понятий статистической физики являются: вероятность и флуктуации.
Вероятность это число способов, которыми может быть реализовано данное состояние макроскопической физической системы (предел, к которому стремится относительная частота появления некоторого события при достаточно большом, стремящемся к бесконечности числе повторений опыта при неизменных внешних условиях):
w = n/N, (12.3)
где N - число опытов;
n - число раз получено определенное событие.
Флуктуации это случайные отклонения физических величин от их среднего значения.
Согласно молекулярно-кинетической теории молекулы идеального газа находятся в непрерывном хаотическом движении с равномерным распределением по направлениям. Скорости молекул при этом изменяются по величине. Наиболее близкой к истинному значению скорости является средняя квадратичная скорость молекул, которая для газа массой "m" находящегося в состоянии равновесия, при T = const, остаётся постоянной
 или
или  , (12.4)
, (12.4)
где Ni - число молекул, обладающих скоростью vi;
N - число всех молекул.
Рассчитаем среднюю квадратичную скорость молекул воздуха при температуре 300К (270С). Будем считать, что воздух состоит из молекул азота (N2) с молярной массой 28 кг/кмоль, тогда

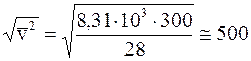 м/с.
м/с.
Постоянство <vкв> объясняется тем, что в стационарном состоянии газа устанавливается стационарное распределение молекул по скоростям, подчиняющееся статистическому закону Максвелла.
Этот закон указывает на существование некоторой наиболее вероятной скорости движения молекул, в окрестности, которой в интервале (v + dv) находится большее число молекул, чем в окрестности другой скорости.
Возможные скорости движения молекул, заключенные в пределах от нуля до бесконечности, не равновероятны. Слишком большие по сравнению со средним квадратичным значением скорости могут реализоваться крайне редко, т.к. для этого должно реализоваться маловероятное явление, когда в результате случайных столкновений молекулы полностью передадут свою энергию одной (или нескольким) молекуле. Точно также практически исключено, что в результате соударений скорость молекулы станет равной нулю. Следовательно, очень малые и очень большие по сравнению со средним значением скорости маловероятны.
Из сказанного следует, что скорости молекул группируются в основном вблизи некоторого наиболее вероятного значения. Впервые функцию распределения молекул по скоростям получил Максвелл в 1860г. Мы воспользуемся готовым результатом и проанализируем его.
Пусть  - общее число молекул, заполняющих сосуд,
- общее число молекул, заполняющих сосуд, 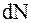 - число молекул, скорости которых заключены в интервале от v до v+dv. Естественно считать, что
- число молекул, скорости которых заключены в интервале от v до v+dv. Естественно считать, что 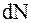 прямо пропорционально общему числу частиц
прямо пропорционально общему числу частиц  и ширине интервала скоростей dv, т.е.
и ширине интервала скоростей dv, т.е.
 (12.5)
(12.5)
При этом коэффициент пропорциональности a должен зависеть от v, т.е. a= f(v). Максвелл получил
 . (12.6)
. (12.6)
Подставляя (12.6) в (12.5) и разделив, обе части равенства, на dv получим
 . (12.7)
. (12.7)
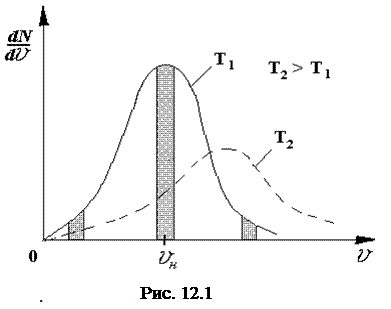 На рисунке 12.1 приведен график зависимости
На рисунке 12.1 приведен график зависимости  для двух температур.
для двух температур.
Проанализируем эту зависимость. Зависимость имеет выраженный максимум, в точке v = vн. Значение vн называют наивероятнейшей скоростью. Если выделить три одинаковых по ширине интервала скоростей в области малых скоростей, в окрестности наивероятнейшей скорости и в области больших скоростей, как показано на рисунке, то можно сделать следующие выводы:
1. Число молекул, имеющих малые скорости, относительно мало.
2. Число молекул, имеющих очень большие скорости, относительно мало.
3. Большая часть молекул движется со скоростями, близкими к наивероятнейшей.
Неожиданным оказывается ответ на вопрос - сколько же молекул имеют вполне определенное значение скорости, например, имеют наивероятнейшую скорость? Ответ – нисколько, нуль !!! Действительно, поскольку ширина заданного интервала скоростей равна нулю, то площадь соответствующей полоски на графике также равна нулю. Т. е., в большой массе молекул, в данное мгновение может не найтись ни одной молекулы, имеющей скорость с точно заданным значением.
Найдем значение наивероятнейшей скорости, для чего исследуем функцию  на экстремум. Возьмем от функции dN/dv производную по v и приравняем ее нулю:
на экстремум. Возьмем от функции dN/dv производную по v и приравняем ее нулю:  . Для упрощения операции обозначим постоянный множитель буквой А, т.е.
. Для упрощения операции обозначим постоянный множитель буквой А, т.е.
 . (12.8)
. (12.8)
Тогда
 (12.9)
(12.9)
Откуда
 . (12.10)
. (12.10)
Таким образом, получаем  .
.
Из выражений (12.10) видно, что с повышением температуры Т максимум исследуемой зависимости смещается вправо (рис. 12.1). Вместе с тем максимум становится ниже. Это объясняется просто: если максимум сместился вправо, то кривая  становится шире, но площадь фигуры, образованной кривой
становится шире, но площадь фигуры, образованной кривой  и осью «O - v» – должна быть одинаковой при Т1 и T2, т.к. указанные площади численно равны одной и той же величине - числу молекул внутри сосуда. Поэтому максимум для кривой
и осью «O - v» – должна быть одинаковой при Т1 и T2, т.к. указанные площади численно равны одной и той же величине - числу молекул внутри сосуда. Поэтому максимум для кривой  при T2 должен быть ниже чем максимум этой кривой для Т1.
при T2 должен быть ниже чем максимум этой кривой для Т1.
По своему численному значению наивероятнейшая скорость близка к средней квадратичной скорости, характеризуется аналогичной зависимостью от температуры.
Молекулы газа, находясь в тепловом движении, непрерывно сталкиваются друг с другом. Минимальное расстояние, на которое сближаются при столкновении центры двух молекул, называется эффективным диаметром молекулы d. Эффективный диаметр несколько уменьшается при увеличении скорости молекул, т. е. с повышением температуры. Величина 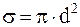 называется эффективным сечением молекулы.
называется эффективным сечением молекулы.
Средний путь, проходимый молекулой между двумя последовательными столкновениями, называется средней длиной свободного пробега <l>.
За 1 с молекула проходит в среднем путь, равный средней скорости  . Если за 1 с в среднем происходит
. Если за 1 с в среднем происходит  столкновений, то средняя длина пробега
столкновений, то средняя длина пробега
 . (12.11)
. (12.11)
 Предположим, что все молекулы, кроме данной молекулы, застыли неподвижно на своих местах (рис. 12.2).
Предположим, что все молекулы, кроме данной молекулы, застыли неподвижно на своих местах (рис. 12.2).
Столкновение происходит в том случае, если центр молекулы, с которой сталкивается данная молекула, лежит внутри цилиндра радиуса d. За 1 с данная молекула столкнется с неподвижными молекулами столько раз, сколько находится внутри такого цилиндра длиной l = │v│∙1 c. Объем этого цилиндра составляет V =  ; число молекул, заключенных в нем N =
; число молекул, заключенных в нем N =  (n – концентрация), следовательно, число столкновений
(n – концентрация), следовательно, число столкновений
 . (12.12)
. (12.12)
В действительности все молекулы движутся, вследствие чего число соударений определяется средней скоростью движения молекул по отношению друг к другу. Как показывает расчет, средняя скорость относительного движения молекул в 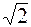 раз больше │v│ (относительно стенок сосуда). Поэтому
раз больше │v│ (относительно стенок сосуда). Поэтому
 (12.13)
(12.13)
Подставляя (12.13) в (12.11), получим
 или
или  . (12.14)
. (12.14)
Поскольку, при постоянной температуре, n изменяется пропорционально p(p = n∙k∙T), то
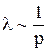 (12.15)
(12.15)
Так, например, при нормальных условиях n = 2,68×1025 м ˉ³, эффективный диаметр молекулы ~1 Å = 10-10 м, поэтому длина свободного пробега l0 = 2×10-7 м, а при давлении 0,1 Па l~0,10 м.
Учёт взаимодействия между молекулами показывает, что при возрастании температуры средняя длина свободного пробега несколько увеличивается. Средняя длина свободного пробега при какой-то температуре Т может быть определена по формуле
 (12.16)
(12.16)
где C - постоянная Сезерленда, зависящая от интенсивности молекулярных взаимодействий.
<lo>- длина свободного пробега молекул без учёта их взаимодействий.
Средняя длина свободного пробега молекул играет большую роль при молекулярно-кинетическом объяснении явлений переноса.
12.3. Распределение Больцмана. Барометрическая формула
Атмосферное давление на какой-либо высоте обусловлено весом вышележащих слоев газа.
Если давление газа на высоте ho равно po, а высоте h - p, то разность давлений с изменением высоты на 
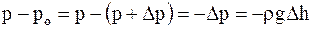 или
или  но r = m/V, а pV = (m/m)×RT, т.е. r = mp/RT, тогда
но r = m/V, а pV = (m/m)×RT, т.е. r = mp/RT, тогда

 . (12.17)
. (12.17)
При T = const, будем иметь
 или
или  (12.18)
(12.18)
но при h = 0, p = p0, C = p0, следовательно
 (12.19)
(12.19)
 Полученное соотношение называют барометрической формулой, которая показывает, что давление убывает с высотой тем быстрее, чем тяжелее газ и чем ниже его температура (рис.12.3).
Полученное соотношение называют барометрической формулой, которая показывает, что давление убывает с высотой тем быстрее, чем тяжелее газ и чем ниже его температура (рис.12.3).
Из молекулярно-кинетической теории известно, что  следовательно
следовательно 
Заменив в барометрической формуле значения давлений, на число молекул в единице объема, с учетом того, что m/R = m/k, получим
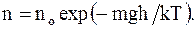 (12.20)
(12.20)
Формула (12.20)определяет закон распределения молекул газа по высоте в поле сил тяготения.
Так как mgh = Wp (потенциальная энергия молекул в поле сил тяготения), то
 (12.21)
(12.21)
где no - число молекул в единице объема в том месте, где потенциальная энергия молекул равна нулю;
n - число молекул в единице объема в тех точках пространства, где потенциальная энергия молекул равна Wp.
Из полученной формулы видно, что с понижением температуры, число молекул на высотах h не равных нулю, убывает и при T®0, оно равно нулю. Таким образом, при температуре T = 0 все молекулы газа расположились бы у поверхности Земли. При T®¥, n слабо убывает с высотой, так что все молекулы оказываются почти равномерно распределенными по высоте. Молекулы располагаются с большей плотностью там, где меньше их потенциальная энергия, и, наоборот, с меньшей плотностью там, где их потенциальная энергия больше. Отсюда
 ;
;  , (12.22)
, (12.22)
где mo - масса одной молекулы.
Больцман показал, что такое распределение молекул справедливо не только в случае потенциального поля тяготения Земли, но и в любом силовом потенциальном поле. Это распределение и называют распределением Больцмана, которое дает распределение частиц по значениям потенциальной энергии.
Распределение частиц по значениям потенциальной энергии было использовано Перреном для экспериментального определения числа Авогадро.