 |
|
ТРИЗ-задание 25. Прозрачность
В опыте, изображённом на рис. 34, сосуд имеет прозрачные стенки. Приведите другие примеры прозрачных технических устройств или их элементов. Какие преимущества это даёт? Сформулируйте изобретательский приём и его название.
16. Уравнение Ван-дер-Ваальса
Из множества различных уравнений, предложенных для реального газа, наиболее простым и точным является уравнение Ван-дер-Ваальса. В модели реального газа Ван-дер-Ваальса молекулы рассматриваются как абсолютно твердые шарики с эффективным диаметром d, между которыми действуют силы взаимного притяжения и отталкивания.
Уравнение Ван-дер-Ваальса является приближенным, так как не существует точного способа вычисления сил взаимодействия между молекулами. Уравнение Ван-дер-Ваальса сводится к поправкам к уравнению идеального газа и для 1 моля имеет вид
 , (80)
, (80)
где a и b – постоянные Ван-дер-Ваальса, определяемые экспериментально для каждого газа, VМ – объём 1 моля.
Поправка 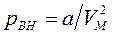 называется внутренним давлением и характеризует добавку к внешнему давлению, обусловленную взаимным притяжением молекул. Из-за притяжения молекул газ как бы сжимает сам себя и поэтому поправка в формуле (80) приводится с «плюсом».
называется внутренним давлением и характеризует добавку к внешнему давлению, обусловленную взаимным притяжением молекул. Из-за притяжения молекул газ как бы сжимает сам себя и поэтому поправка в формуле (80) приводится с «плюсом».
Поправка b = 4 NA VМОЛ равна учетверённому значению собственного объёма всех молекул, где NA – число Авогадро (так как взят 1 моль газа), VМОЛ – объём одной молекулы. Если, например, в сосуде находятся две молекулы, то центр любой из них не может приблизиться к центру другой молекулы на расстояние, меньшее диаметра d молекулы (рис. 13). Это означает, что для центров обеих молекул оказывается недоступным для движения сферический объём радиуса d, т.е. объём, равный 8 объёмам молекулы или учетверённому объёму молекулы в расчете на одну молекулу. Поэтому в уравнении Ван-дер-Ваальса вместо полного объёма сосуда стоит «свободный» для движения объём, который получается вычитанием собственного объёма молекул.

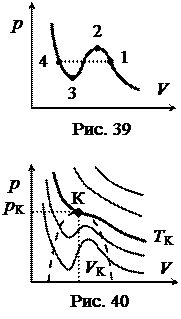 Уравнение Ван-дер-Ваальса – это уравнение третьей степени относительно V. Поэтому изотерма Ван-дер-Ваальса при температуре ниже критической будет иметь вид, показанный на рис. 39. Как видно, она отличается от изотермы реального газа (пунктир). Однако при некоторых условиях участки 1–2 и 3–4 могут наблюдаться в эксперименте. Это так называемые метастабильные состояния (очень неустойчивые). На участке 1–2 можно получить пересыщенный пар (применяется в камере Вильсона). На участке 3–4 реализуется перегретая жидкость (применяется в пузырьковой камере).
Уравнение Ван-дер-Ваальса – это уравнение третьей степени относительно V. Поэтому изотерма Ван-дер-Ваальса при температуре ниже критической будет иметь вид, показанный на рис. 39. Как видно, она отличается от изотермы реального газа (пунктир). Однако при некоторых условиях участки 1–2 и 3–4 могут наблюдаться в эксперименте. Это так называемые метастабильные состояния (очень неустойчивые). На участке 1–2 можно получить пересыщенный пар (применяется в камере Вильсона). На участке 3–4 реализуется перегретая жидкость (применяется в пузырьковой камере).
Семейство изотерм Ван-дер-Ваальса показано на рис. 40. Постоянные Ван-дер-Ваальса можно найти из критических параметров рК, ТК, VК. Как видно из рис. 40, критическая точка К является точкой перегиба изотермы, поскольку в ней совмещаются и минимумы, и максимумы. Следовательно, в критической точке и первая, и вторая производные будут равны нулю. Если решить уравнение Ван-дер-Ваальса относительно давления р:
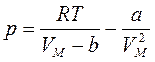 ,
,
а затем взять первую и вторую производные и приравнять их к нулю, то можно получить связь постоянных Ван-дер-Ваальса и критических параметров:
 ,
, 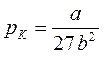 ,
, 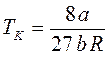 ,
,  ,
,  .
.
Чтобы написать уравнение Ван-дер-Ваальса для произвольного числа молей n, нужно учесть, что n молей газа занимают в n раз больший объем V = VM n. Подставим в уравнение (80) выражение VM = V/n, а затем умножим обе части равенства на n. Получаем уравнение Ван-дер-Ваальса для произвольного числа молей:
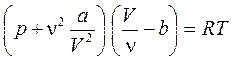 ,
, 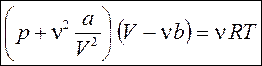 . (81)
. (81)
При сильном разряжении газа, когда взаимодействием между молекулами можно пренебречь, уравнение Ван-дер-Ваальса переходит в уравнение Менделеева-Клапейрона.
Внутренняя энергия газа Ван-дер-Ваальса должна включать кроме кинетической энергии молекул (которую мы раньше определили для идеального газа) и энергию взаимодействия между молекулами. Для вывода формулы воспользуемся тем, что работа, совершаемая при расширении газа против сил взаимного притяжения молекул, равна изменению потенциальной энергии dA = dEP. Силы взаимного притяжения учтены в уравнении Ван-дер-Ваальса с помощью добавки к давлению  . Работа равна:
. Работа равна:
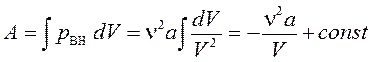 .
.
Внутренняя энергия газа Ван-дер-Ваальса равна сумме кинетической и потенциальной энергий:
 .
.
Найдем постоянную интегрирования. Если газ расширяется, то силами взаимодействия в разряженном газе можно пренебречь и получается идеальный газ. Значит, при стремлении объёма газа к бесконечности формула для внутренней энергии газа Ван-дер-Ваальса должна переходить в формулу для внутренней энергии идеального газа. Второе слагаемое в формуле внутренней энергии газа Ван-дер-Ваальса стремится к нулю при стремлении объёма к бесконечности. Поэтому постоянную интегрирования также следует положить равной нулю. В итоге имеем формулу для внутренней энергии газаВан-дер-Ваальса:
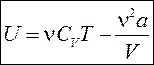 . (82)
. (82)
Таким образом, внутренняя энергия газа Ван-дер-Ваальса зависит не только от температуры, но и от объёма газа.
ТРИЗ-задание 26. Опоздание на 40 лет
 «Изобретения всегда опаздывают», – это первая фраза, произнесённая Г.С. Альтшуллером в фильме «Алгоритм изобретений» (студия «Центрнаучфильм», 1974 г.). Данное высказывание можно подтвердить примером из области детекторов заряженных частиц. В камере Вильсона, изобретённой в 1912 г., рабочим веществом является переохлаждённый (пересыщенный) пар. Регистрируемая заряженная частица конденсирует пар на своём пути, оставляя след (трек) из мелких капель жидкости. В 1952 г.Д. Глезер (США) изобрёл пузырьковую камеру. В ней трек заряженной частицы образуется пузырьками пара в перегретой (выше точки кипения) жидкости. За эти два изобретения были получены две Нобелевские премии: Ч. Вильсоном – в 1927 г., Д. Глезером – в 1960 г. Вопрос: с учётом принципов работы камер какой изобретательский приём позволил бы ещё в 1912 г. получить идею пузырьковой камеры?
«Изобретения всегда опаздывают», – это первая фраза, произнесённая Г.С. Альтшуллером в фильме «Алгоритм изобретений» (студия «Центрнаучфильм», 1974 г.). Данное высказывание можно подтвердить примером из области детекторов заряженных частиц. В камере Вильсона, изобретённой в 1912 г., рабочим веществом является переохлаждённый (пересыщенный) пар. Регистрируемая заряженная частица конденсирует пар на своём пути, оставляя след (трек) из мелких капель жидкости. В 1952 г.Д. Глезер (США) изобрёл пузырьковую камеру. В ней трек заряженной частицы образуется пузырьками пара в перегретой (выше точки кипения) жидкости. За эти два изобретения были получены две Нобелевские премии: Ч. Вильсоном – в 1927 г., Д. Глезером – в 1960 г. Вопрос: с учётом принципов работы камер какой изобретательский приём позволил бы ещё в 1912 г. получить идею пузырьковой камеры?
17. Особенности жидкого состояния
вещества и воды
Жидкость, занимая промежуточное положение между газами и кристаллами, сочетает в себе свойства обоих видов этих тел.
1. Как и твёрдое тело, жидкость малосжимаема из-за плотного расположения молекул. (Однако если бы вода могла полностью освободиться от сжатия, то уровень воды в мировом океане поднялся бы на 35 м и вода затопила бы 5 000 000 км2 суши.)
2. Как и твёрдое тело, жидкость сохраняет объём, но подобно газу принимает форму сосуда.
3. Для кристаллов характерен дальний порядок в расположении атомов (кристаллическая решетка), для газов – полный хаос. Для жидкости существует промежуточное состояние – ближний порядок, т.е. расположение только ближайших молекул упорядоченно. При удалении от данной молекулы на расстояние 3–4 эффективных диаметра молекулы упорядоченность размывается. Поэтому жидкости близки к поликристаллическим телам, состоящим из очень мелких кристаллов (размерами около 10-9 м), произвольно ориентированных друг относительно друга. Благодаря этому свойства большинства жидкостей одинаковы по всем направлениям (и нет анизотропии, как в кристаллах).
4. Большинство жидкостей, как и твёрдые тела, при увеличении температуры увеличивают свой объём, уменьшая при этом свою плотность (при критической температуре плотность жидкости равна плотности её пара). Вода отличается известной аномалией, состоящей в том, что при +4 °С вода обладает максимальной плотностью. Эта аномалия объясняется тем, что молекулы воды частично собираются в группы из нескольких молекул (кластеры), образуя своеобразные большие молекулы Н2О, (Н2О)2, (Н2О)3 … с разной плотностью. При различных температурах соотношение концентраций этих групп молекул разное.
Существуют аморфные тела (стекло, янтарь, смолы, битумы...), которые принято рассматривать как переохлажденные жидкости с очень высоким коэффициентом вязкости. Они имеют одинаковые свойства по всем направлениям (изотропны), ближний порядок в расположении частиц, у них нет температуры плавления (при нагреве вещество постепенно размягчается и переходит в жидкое состояние).
В технике применяются магнитные жидкости – это обычные жидкости (вода, керосин, различные масла), в которые введены (до 50%) мельчайшие частицы (размером в несколько микрон) твердого ферромагнитного материала (например, Fe2O3). Перемещением магнитной жидкости и её вязкостью можно управлять магнитным полем. В сильных магнитных полях магнитная жидкость мгновенно твердеет.
Некоторые органические вещества, молекулы которых имеют нитевидную форму или форму плоских пластин, могут находиться в особом состоянии, обладая одновременно свойствами анизотропии и текучести. Они называются жидкими кристаллами. Для изменения ориентации молекул жидкого кристалла (при этом изменяется его прозрачность) требуется напряжение около 1 В и мощность порядка микроватт, что можно обеспечить непосредственной подачей сигналов с интегральных схем без дополнительного усиления. Поэтому жидкие кристаллы широко применяются в индикаторах электронных часов, калькуляторах, дисплеях.
При замерзании вода увеличивается в объеме на 11%, и если вода замерзает в замкнутом пространстве, может достигаться давление 2500 атмосфер (разрушаются водопроводные трубы, горные породы...).
 У воды одна из самых больших: 1) диэлектрическая проницаемость (поэтому вода является хорошим растворителем, особенно солей с ионными связями – в Мировом океане содержится вся таблица Менделеева); 2) теплота плавления (медленное таяние снега весной); 3) теплота парообразования; 4) поверхностное натяжение; 5) теплоёмкость (мягкий климат прибрежных районов).
У воды одна из самых больших: 1) диэлектрическая проницаемость (поэтому вода является хорошим растворителем, особенно солей с ионными связями – в Мировом океане содержится вся таблица Менделеева); 2) теплота плавления (медленное таяние снега весной); 3) теплота парообразования; 4) поверхностное натяжение; 5) теплоёмкость (мягкий климат прибрежных районов).
Существует легкая (1 г/см3) и тяжелая (1,106 г/см3) вода. Легкая вода («живая») – биологически активна – это окись протия Н2О. Тяжелая вода («мертвая») – подавляет жизнедеятельность организмов – это окись дейтерия D2O. Протий (1 а.е.м.), дейтерий (2 а.е.м.) и тритий (3 а.е.м.) – это изотопы водорода. Существуют также и 6 изотопов кислорода: от 14О до 19О, которые могут находиться в молекуле воды.
При обработке воды магнитным полем изменяются её свойства: изменяется смачиваемость твердых тел, ускоряется их растворение, изменяется концентрация растворенных газов, предотвращается образование накипи в паровых котлах, ускоряется в 4 раза затвердевание бетона и повышается его прочность на 45%, оказывается биологическое воздействие на человека (магнитные браслеты и серьги, магнитофоры и т.п.) и растения (повышается всхожесть и урожайность сельскохозяйственных культур).
Серебряная вода может долго храниться (около полугода), так как происходит обезвреживание воды от микробов и бактерий ионами серебра (применяется в космонавтике, для консервирования продуктов, обеззараживания воды в бассейнах, в лечебных целях для профилактики и борьбы с желудочно-кишечными заболеваниями и воспалительными процессами).
Обеззараживание питьевой воды в городских водопроводах осуществляется хлорированием и озонированием воды. Существуют и физические методы обеззараживания при помощи ультрафиолетового излучения и ультразвука.
Растворимость газов в воде зависит от температуры, давления, минерализации, присутствия в водном растворе других газов. В 1 л воды при 0 °С может быть растворено: гелия – 10 мл, углекислого газа – 1713 мл, сероводорода – 4630 мл, аммиака – 1300000 мл (нашатырный спирт). Аквалангисты при погружении на большие глубины используют специальные дыхательные смеси, чтобы при всплытии не получилась «газированная кровь» из-за растворения в ней азота.
Все живые организмы на 60–80% состоят из воды. Кровь человека и животных по составу солей близка к океанической воде. Человек и животные могут в своих организмах синтезировать воду, образовывать её при сгорании пищевых продуктов и самих тканей. У верблюда, например, жир, содержащийся в горбу, может в результате окисления дать 40 л воды.
При электролизе воды можно получить два её вида: 1) кислую воду («мертвую»), которая действует как антисептическое средство (аналогично тому, как в кислом желудочном соке погибают многие болезнетворные микробы); 2) щелочную воду («живую»), которая активизирует биологические процессы (повышает урожайность, быстрее заживляет раны и т.п.).
О других особенностях воды (структурированной, энергоинформационной и др.) можно узнать из Интернета.