 |
|
Фазовая диаграмма состояний
Рассмотрим подробнее фазовые переходы первого рода.
Процесс парообразования, происходящий со свободной поверхности жидкости, называется испарением. Испарение происходит при любой температуре и возрастает при её повышении. Силу притяжения поверхностного слоя способны преодолеть только «наиболее быстрые» молекулы, обладающие достаточной кинетической энергией. Поэтому жидкость при испарении охлаждается. Этим эффектом объясняется ощущение сильного охлаждения кожи, смоченной эфиром или спиртом.
Количество теплоты, которое необходимо подвести к определённому количеству жидкости (килограмму, молю), чтобы испарить её изотермически, при внешнем давлении, равном упругости её насыщенных паров, называется скрытой теплотой испарения (парообразования). Это количество теплоты уменьшается при увеличении температуры и становится равным нулю при критической температуре (так как исчезают различия между жидкостью и её паром).

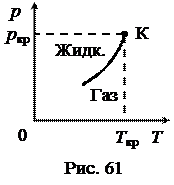 Пусть имеется закрытый сосуд с жидкостью (рис. 60), и первоначально в верхней части сосуда есть вакуум. Жидкость начнет испаряться и наступит динамическое равновесие – плотность пара перестанет изменяться. Пар, находящийся в равновесии со своей жидкостью, называется насыщенным, а его давление называется давлением (упругостью) насыщенного пара. При увеличении температуры испарение увеличивается и возрастает давление насыщенного пара. Эта зависимость показана на рис. 61. Кривая фазового перехода «жидкость - пар» ограничена сверху критической точкой (К). Математически эта зависимость определяется уравнением Клапейрона-Клаузиуса:
Пусть имеется закрытый сосуд с жидкостью (рис. 60), и первоначально в верхней части сосуда есть вакуум. Жидкость начнет испаряться и наступит динамическое равновесие – плотность пара перестанет изменяться. Пар, находящийся в равновесии со своей жидкостью, называется насыщенным, а его давление называется давлением (упругостью) насыщенного пара. При увеличении температуры испарение увеличивается и возрастает давление насыщенного пара. Эта зависимость показана на рис. 61. Кривая фазового перехода «жидкость - пар» ограничена сверху критической точкой (К). Математически эта зависимость определяется уравнением Клапейрона-Клаузиуса:
 , (88)
, (88)
где L – удельная (молярная) скрытая теплота парообразования; V1, V2 – удельные (молярные) объёмы веществ в исходной (жидкость) и конечной (пар) фазах; р и Т – давление и температура фазового перехода.
Кипением называется интенсивное испарение жидкости не только со свободной поверхности, но и во всем объёме жидкости внутрь образующихся при этом пузырьков пара.
Кипение начинается при такой температуре, при которой давление насыщенного пара внутри пузырька рН не меньше суммы трех давлений: внешнего (атмосферного), гидростатического и давления Лапласа pH ³ p0 + rgh + 2s/r, где r – радиус пузырька пара; h – расстояние от его центра до поверхности жидкости. Если это условие не выполняется, то происходит «захлопывание» пузырька и конденсация находящегося в нем пара. При наличии в жидкости центров парообразования двумя последними слагаемыми можно пренебречь и приближенное условие для кипения будет иметь вид рН » р0. Итак, температура жидкости, при которой давление её насыщенного пара равно внешнему давлению, называется температурой кипения.
Таким образом, температура кипения жидкости зависит от внешнего давления. Например, вода при 40 атм кипит при 250 °С, а на высоте Эвереста (h = 8848 м, р = 234 мм рт. ст.) – при 70 °С. Вода, нормально кипящая при 100 °С (при 1 атм), может кипеть и при комнатной температуре, если блюдце с водой поставить под колпак воздушного насоса и понизить внешнее давление. Тепло, необходимое для превращения жидкости в пар, забирается у самой жидкости, она охлаждается и может даже замерзнуть, интенсивно испаряясь с большой поверхности блюдца.
 Если жидкость однородна и в ней нет центров парообразования, то можно получить перегретую жидкость, нагрев её выше температуры кипения.
Если жидкость однородна и в ней нет центров парообразования, то можно получить перегретую жидкость, нагрев её выше температуры кипения.
Поскольку объём пара больше объёма такой же массы жидкости, то разность объемов (VП – VЖ) всегда больше нуля. Величины T и L в уравнении Клапейрона-Клаузиуса (88) также положительны. Значит, производная dp/dT (тангенс угла наклона кривой) положительна, а следовательно, при увеличении давления температура кипения возрастает.
 Переход кристаллического тела в жидкое состояние (плавление) требует затраты некоторого количества теплоты, называемого теплотой плавления. Температура плавления зависит от внешнего давления. При нагревании твёрдое тело расширяется и увеличиваются средние расстояния между частицами. Если препятствовать этому расширению внешним давлением, то вещество будет плавиться при более высокой температуре. Кривая плавления (рис. 62) соответствует следующему уравнению Клапейрона-Клаузиуса:
Переход кристаллического тела в жидкое состояние (плавление) требует затраты некоторого количества теплоты, называемого теплотой плавления. Температура плавления зависит от внешнего давления. При нагревании твёрдое тело расширяется и увеличиваются средние расстояния между частицами. Если препятствовать этому расширению внешним давлением, то вещество будет плавиться при более высокой температуре. Кривая плавления (рис. 62) соответствует следующему уравнению Клапейрона-Клаузиуса:
 ,
,
где LПЛ – удельная теплота плавления; VЖ, VТ – удельные объёмы жидкой и твердой фаз; Т – температура плавления при давлении р. Если VЖ > VТ, то dp/dT > 0. Это значит, что при увеличении давления температура плавления возрастает (сплошная линия на рис. 62). Для некоторых веществ (лёд, чугун, висмут, сурьма, германий) объём при плавлении уменьшается. Для них VЖ < VТ, производная dp/dT отрицательна, и на рис. 62 показан пунктиром другой наклон кривой плавления. Температура плавления для таких веществ уменьшается при увеличении давления. На диаграмме кривая плавления идет очень круто. Например, для того чтобы изменить температуру плавления льда на 1 градус, необходимо изменить давление на 132 атм.
 Переход твёрдого тела непосредственно в газообразное состояние называется сублимацией, или возгонкой (например, нафталин или «сухой лед» – углекислота). Испаряющиеся частицы твёрдого тела (аналогично жидкости) также могут образовывать насыщенный пар. Давление насыщенного пара возрастает при увеличении температуры (рис. 63). Возгонка так же, как и плавление, связана с разрушением кристаллической решетки и требует затраты для этого скрытойтеплоты сублимации. Наклон кривой сублимации определяется уравнением Клапейрона-Клаузиуса. Для многих тел при нормальных условиях сублимация очень мала.
Переход твёрдого тела непосредственно в газообразное состояние называется сублимацией, или возгонкой (например, нафталин или «сухой лед» – углекислота). Испаряющиеся частицы твёрдого тела (аналогично жидкости) также могут образовывать насыщенный пар. Давление насыщенного пара возрастает при увеличении температуры (рис. 63). Возгонка так же, как и плавление, связана с разрушением кристаллической решетки и требует затраты для этого скрытойтеплоты сублимации. Наклон кривой сублимации определяется уравнением Клапейрона-Клаузиуса. Для многих тел при нормальных условиях сублимация очень мала.
Совместим все полученные зависимости на одном графике, который называется фазовой диаграммой состояний (рис. 64). В зависимости от объёмов VЖ и VТ имеются разные кривые плавления. Кривые плавления, парообразования и сублимации (линии равновесия двух фаз) пересекаются втройной точке Тр (равновесие трех фаз). Кривые сублимации и парообразования имеют начало и конец (0, Тр, К). Кривая плавления конца не имеет. Для воды в тройной точке ртр = 4,6 мм рт.ст. и tтр = 0,0075 °С, поэтому при атмосферном давлении при нагреве лёд сначала плавится, а затем вода превращается в пар. Для углекислоты ртр = 5 атм, tтр = – 56,6 °С. Поэтому углекислота при атмосферном давлении может находиться только в твёрдом и газообразном состояниях.
 Фазовая диаграмма показывает, что при нагревании кристаллическое вещество можно расплавить лишь при условии р > ртр.
Фазовая диаграмма показывает, что при нагревании кристаллическое вещество можно расплавить лишь при условии р > ртр.
Поскольку кривая парообразования заканчивается в критической точке, возможен непрерывный переход вещества из жидкого состояния в газообразное и обратно. Такой переход не сопровождается фазовыми превращениями. Это связано с тем, что различие между жидкостью и газом является чисто количественным (большее или меньшее взаимодействие между молекулами). Жидкости и газы – изотропны. А жидкости и кристаллы отличаются качественно – различной симметрией внутреннего строения.
Тройных точек может быть несколько. Например, сера имеет три тройные точки, так как может существовать в двух кристаллических модификациях – моноклинной и ромбической, обозначенных на рис. 65 как «м» и «ромб.». При атмосферном давлении при нагреве ромбические кристаллы переходят в моноклинные, затем плавятся и закипают (см. пунктир на рис. 65).