 |
|
Структурні складові залізовуглецевих сплавів
ДІАГРАМА СТУНУ СПЛАВІВ СИСТЕМИ «ЗАЛІЗО-ВУГЛЕЦЬ»
Мета роботи. 1. Вивчити методику побудови діаграми фазової рівноваги на прикладі двокомпонентної системи Fe- C.
2. Ознайомитися з компонентами, фазами, структурними складовими залізовуглецевих сплавів та фазовими перетвореннями, що відбуваються в них під час охолодження (нагріву).
Короткі теоретичні відомості
Загальні поняття
Діаграма стану сплавів – це геометричне місце критичних точок переходу системи із одного агрегатного стану в інший в залежності від температури і концентрації сплавів. Критичними називають точки, які відповідають температурам фазових перетворень під час охолодження (нагріву) сплаву.
Для розуміння діаграм стану сплавів необхідно дати визначення наступним термінам і поняттям, які необхідні для їх вивчення.
Сплав. Сплавами називають речовини, отримані в процесі сплавлення, спікання, сублімації двох або більше металів з металами або неметалами.
У порівнянні з чистими металами сплави володіють більш високим комплексом механічних, фізичних, хімічних та технологічних властивостей і є найбільш розповсюдженим матеріалом у машинобудуванні.
В залежності від атомної будови хімічних елементів сплави можуть собою представляти механічні суміші, тверді розчини з необмеженою або обмеженою розчинністю та хімічні сполуки.
Система. Під системою розуміють сукупність речовин, обраних для вивчення впливу на них певних факторів (температура, тиск, концентрація).
Компонент. Компонент- це незалежні речовини, що утворюють систему. В металознавстві компонентами вважають метали і неметали, які утворюють сплав. Отже, чистий метал представляє однокомпонентну систему, сплави із двох елементів – двокомпонентну систему і т.д. Число компонентів у сплавах позначають літерою К.
Фаза. Фаза – це хімічно однорідна частина системи відокремлена від інших частин (фаз) поверхнею, розділу. У сплавах фазами можуть бути чистий метал, рідкі або тверді розчини, хімічні сполуки. Фази відрізняються між собою за агрегатним станом, хімічним складом, типом кристалічної гратки. Число співіснуючих фаз у сплавах позначають літерою Ф.
Діаграма стану сплавів залізо-вуглець дає уяву про перетворення і будову в області існування сталей і чавунів – найбільш поширених металевих сплавів у машинобудуванні. Компонентами цих сплавів є залізо і вуглець.
Залізо.Залізо (лат. Ferum) – хімічний елемент VIII групи періодичної системи Д.І. Менделєєва, порядковий номер 26, атомна маса 55,75, щільність 7800кг/м3, температура плавлення 1536 оС, температура кипіння 2740 оС. Метал сріблясто-сірого кольору. Твердість по Бринелю 600 МПа.
Залізо володіє алотропією (поліморфізмом), тобто здатністю змінювати свою кристалічну будову в залежності від температури. При цьому процес зміни кристалічної однієї гратки у іншу називають алотропічним перетворенням, а будову металу, отриману в результаті алотропічного перетворення – алотропічною формою. Алотропічні форми позначають початковими літерами грецького алфавіту α, β, γ, δ.
Перетворення однієї алотропічної форми в іншу чистого металу супроводжується поглинанням тепла і відбувається при постійній температурі. Тому на термічній кривій в координатах температура – час перетворення позначається горизонтальною лінією (рис. 6.1).
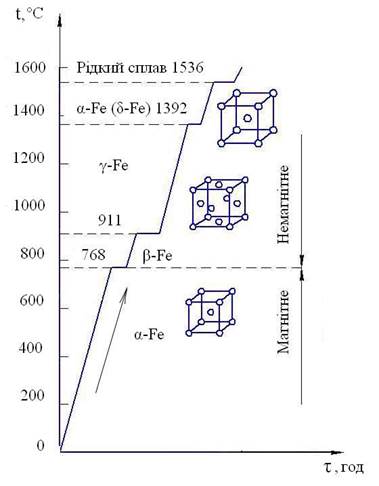
Рис. 6.1 Алотропічні перетворення заліза
При кімнатній температурі залізо має гратку об’ємноцентрованого куба (ОЦК). Якщо залізо нагрівати, то гратка ОЦК ( модифікація α - Fe) зберігається до температури 911оС.
При температурі 768 оС на термічній кривій є горизонтальна ділянка, яка пов’язана не з перебудовою гратки, а зміною магнітних властивостей заліза (точка Кюрі). Вище температури 768 оС α- залізо повністю втрачає феромагнітні властивості. Немагнітне α - залізо іноді називають β – залізом.
При температурі 911 оС гратка ОЦК перебудовується у гратку, яка носить назву гранецентрованого куба (ГЦК) – модифікація γ- Fe.
При нагріванні гратка ГЦК при температурі 1392 оС знову перебудовується у гратку ОЦК (α - Fe), яку позначають літерою δ (δ – Fe).
В подальшому при температурі 1536 оС залізо плавиться і переходить у рідкий стан, якій на діаграмах стану сплавів позначають літерою Р.
При охолодженні рідини (Р) розглянуті алотропічні перетворення заліза відбуваються у зворотному порядку.
Вуглець. Вуглець – це неметалевий хімічний елемент IV групи періодичної системи Д.І. Менделєєва, порядковий номер 6 , атомна маса 12,01. В природі існує у двох модифікаціях: графіту і алмазу.
Графіт має гексагональну кристалічну гратку. Щільність графіту 2500кг/м3, за нормальних умов є стабільним. Він м’який, пластичний, температура плавлення (сублімації) становить 3500 оС.
Алмаз є метастабільною модифікацією, яка утворюється при температурі 3670 оС і тиску 120 атм і у залізовуглецевих сплавах не трапляється.
Структурні складові залізовуглецевих сплавів
Основними структурними складовими залізовуглецевих сплавів є рідкі та тверді розчини вуглецю у залізі, цементит та графіт. У рідкому стані вуглець в залізі розчинюється до 4,3% при температурі 1147°С. До твердих розчинів вуглецю у залізі відносять ферит і аустеніт.
Ферит (Ф) – це твердий розчин втілення вуглецю на основі α - заліза з об’ємноцентрованою кубічною граткою (ОЦК). Високотемпературна модифікація ферита δ - ферит має максимальну концентрацію вуглецю 0,1%. У низькотемпературному α - фериті максимальна розчинність вуглецю при 727 °С становить 0,025% і при зниженні температури зменшується практично до нуля. Ферит – м’який, пластичний, має твердість НВ 80…100; магнітний при температурах нижче 768 °С.
Аустеніт (А) – це твердий розчин втілення вуглецю на основі γ - заліза з кубічною гранецентрованою кристалічною граткою (ГЦК). Розчинність вуглецю в γ - залізі підвищується при зростанні температури і досягає максимуму (2,14 %С) при температурі 1147°С. Аустеніт – пластичний, немагнітний, має твердість близько НВ 170; твердість легованого аустеніту може становити НВ 200…300.
Цементит (Ц) –це хімічна сполука вуглецю і заліза – карбід заліза Fe3C. Він містить 6,67 %С, має складну ромбічну кристалічну гратку з 12 атомами заліза і 4 вуглецю. Температура плавлення біля 1250°С. Цементит найбільш тверда (НВ780) і дуже крихка фаза в системі залізо-вуглець, нижче температури 217 °С – магнітний.
У сплавах з вмістом вуглецю більше 4,3 %, а також легованих високо вуглецевих сталях у місцях підвищеної неоднорідності одразу з розплаву випадає первинний цементит. Вторинний цементит виділяється з аустеніту вздовж лінії SE діаграми, третинний – з фериту вздовж лінії ОР.
Перліт (П) –евтектоїдна (механічна) суміш фериту і цементиту, яка утворюється при температурі 727 °С, з вмістом вуглецю 0,8 %. Назва «перліт» (перл) походить від англійського слова «pearl», так як його структура подібна до перламутру. У залежності від будови перліту змінюються і його властивості: пластинчастий перліт більш твердий, крихкий і міцніший від зернистого (НВ 160…230; σв=600…800МПа; δ=15…20 %).
Ледебурит (Л) –це евтектична (механічна) суміш аустеніту і цементиту (вище 727 °С) або перліту і цементиту (нижче 727 °С). Ледебурит утворюється при вмісті вуглецю 4,3 % і температурі 1147 °С.
Графіт (Г) –одна з поліморфних модифікацій (різновидів) вуглецю з гексагональною кристалічною граткою. Має низьку твердість, міцність, питома вага графіту - 2,5 г/см3. Графіт – структурна складова чавунів. У сірому чавуні він має вигляд пластин різної форми і розмірів; у ковкому – форму пластівців; у високоміцному – кулясту (сферичну) форму. Графіт виявляється на макрошліфі без протравлення. У залізовуглецевих сплавах графіт є стабільною високо вуглецевою фазою, а цементит – лише відносно стійкою (метастабільною) фазою.
3. Діаграми стану Fe-Fe3C
Вивчення діаграми залізо-вуглець започатковано російським вченим Д.К. Черновим у 1868 р.і опубліковано у роботі «Критический обзор статей Лаврова и Калакуцкого о стали и стальных орудиях и собственные исследования Д.К. Чернова по этому же предмету». У цій роботі Д.К. Чернов вперше у світі встановив існування у сталях критичних точок в залежності від вмісту у них вуглецю і графічно представив їх у вигляді діаграми. При цьому положення критичних точок визначалась зміною властивостей сталей в залежності від режимів її термічної обробки (температура нагріву, швидкість охолодження)
Із розвитком технічних засобів і наукових розробок положення критичних точок уточнювалось. Так, Осмонд визначив положення критичних точок за допомогою пірометра, винайденого Ле-Шательє і описав перетворення, які відбуваються у сталі при переході через критичні точки. В подальшому перетворення, що відбувається при нагріванні сталі, вивчалися металографічними методами Р.Аустеном, Ле-Шательє, А.А.Байковим, Н.Т. Гутцовим та іншими вченими. При цьому уточнялися тільки положення критичних точок і вміст вуглецю у різних структурних складових.
Діаграма стану залізовуглецевих сплавів це – графічне зображення фазового стану сплавів Fe та С в залежності від вмісту вуглецю і температури за умов дуже повільного (рівноважного) охолодження і нагрівання. Вона дає уявлення про перетворення і фазово-структурний стан залізовуглецевих сплавів в області існування сталей (до 2,14 %С) і чавунів (від 2,14 до 6,67 %С), слугує основною для вибору температури при термообробці залізовуглецевих сплавів.
Діаграма (рис.6.2) показана у спрощеному вигляді – лише для інтервалу концентрації вуглецю від 0 до 6,67 %, тобто до утворення хімічної сполуки Fe3C – карбіду заліза (цементит), який поводить себе як самостійний компонент. Лише ця частина діаграми має практичне значення, оскільки сплави з більш високим вмістом вуглецю дуже крихкі і на практиці не використовуються.
По осі абсцис на цій діаграмі показано концентрацію вуглецю у вагових процентах, а по осі ординат – температуру в °С. Для переводу концентрації вуглецю в концентрацію цементиту слід вміст вуглецю помножити на 15.
Відзначимо, що при охолодженні залізовуглецевих сплавів вуглець може не тільки хімічно взаємодіяти з залізом, утворюючи карбід заліза – Fe3C, але й виділятись у вигляді графіту. Тому розрізняють дві діаграми стану: залізо-цементит (Fe – Fe3C) і залізо-графіт (Fe – C). Першу зображають суцільними лініями, другу – штриховими.
Оскільки цементит за певних умов розпадається з утворенням вільного вуглецю (графіту), - діаграму перетворення в системі Fe – Fe3C називають нестабільною (метастабільною), а у системі Fe – C – стабільною.
Всі лінії системи Fe – C розташовані на діаграмі вище лінії системи Fe – Fe3C, евтектичне і евтектоїдне перетворення відбуваються при більш високих температурах (1153°С і 738°С відповідно). Точки С, Е, S зміщенні вліво (С′=2,26%, E′=2,11%, S′=0,7%). Лінія С’E’S’ відповідає температурі утворення графітної евтектики (аустеніт + графіт), лінія P′S′K′ – евтектоїдну (ферит + графіт), по лінії E′S′ виділяється вторинний графіт.
