|
|
Хімічні властивості Гідрогену
Гідроген — один з рекордсменів за числом різноманіття сполук. Найбільша їхня кількість припадає на сполуки з Карбоном, які вивчає органічна хімія.
Але й неорганічні сполуки Гідрогену дуже різноманітні.
В таблиці наведено приклади сполук Гідрогену з типовими s- і р-елементами, Вказаний ступінь окиснення Гідрогену у всіх сполуках.
| Другий період | ||||||||
| літій гідрид | берилій гідрид | метан | амоніак | вода | фтористий водень | |||
| -1 | -1 | +1 | +1 | +1 | +1 | |||
| LiH | ВеH2 | CH4 | NH3 | H2O | HF | |||
| твердий | твердий | газ | газ | рідина | рідина | |||
| Третій період | ||||||||
| магній гідрид | силан | фосфін | сірководень | хлористий водень | ||||
| -1 | -1 | -1 | +1 | +1 | ||||
| MgH2 | SiH4 | PH3 | H2S | HCl | ||||
| твердий | газ | газ | газ | газ | ||||
Сполуки металів з Гідрогеном (вони називаються гідридами металів) є твердими речовинами. Гідриди металів можна добувати безпосередньо з металу та водню:
Са + Н2 → СаН2 (кальцій гідрид, tпл = 1000 °С)
Гідриди бурхливо реагують з водою з утворенням газуватого водню:
СаН2 + 2Н2O → Са(ОН)2 + 2Н2.
Це ще один зручний спосіб добування газуватого водню. Джерелом атомів Гідрогену є як гідрид металу, так і вода. Тому для добування 1 м3 водню необхідно всього 0,94 кг кальцій гідриду, тоді як для добування тієї ж кількості газу дією металів на кислоти потрібно 2,5 кг заліза або 2,9 кг цинку.
Сполуки Гідрогену з неметалами переважно є газами. Виняток становить вода та фтороводень. Така різка відмінність води від інших летких сполук Гідрогену пояснюється існуванням між молекулами води особливого виду хімічного зв’язку — водневого.
З усіх сполук Гідрогену однією з найважливіших є амоніак, який добувають реакцією водню з азотом за високої температури, тиску й у присутності каталізатора:

Це один з небагатьох хімічних процесів, що дозволяють зв’язувати досить інертний атмосферний азот. Надалі з активнішого в хімічному відношенні амоніаку добувають безліч нітратних сполук — нітратну кислоту, барвники, вибухові речовини, нітратні добрива.
Відновні властивості Гідрогену використовують для добування чистих металів з їхніх оксидів. Наприклад, під час нагрівання купрум(ІІ) оксиду СuО у струмені водню утворюється вода і порошок міді:
СuО + Н2 → Сu + Н2O.
Для деяких дуже тугоплавких металів відновлення їхніх оксидів воднем виявляється зручним і економічним способом добування. Наприклад, метал вольфрам, з якого роблять нитки лампочок розжарювання, добувають за допомогою реакції:
WO3 + 3Н2 → W + 3Н2O.
Метал виходить у вигляді порошку, який потім можна пресувати в готові вироби. Після спікання такі вироби не вимагають подальшої обробки. Цей спосіб добування металів і деталей з них називається порошковою металургією.
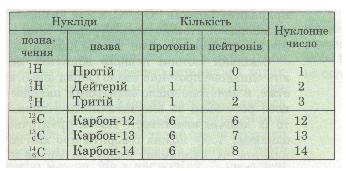
Ізотопи Гідрогену
Атом Гідрогену — найпростіший з усіх атомів. Його ядро складається з єдиного протона. Цей (найпоширеніший) ізотоп Гідрогену називають також протієм, щоб відрізнити від дейтерію — іншого ізотопу Гідрогену, у ядрі якого міститься 1 протон і 1 нейтрон. Дейтерій перебуває у природі в дуже невеликій кількості. Проте його навчилися виділяти для потреб ядерної енергетики. Дейтерій — один з небагатьох ізотопів у хімії, який має свій власний символ D. Найвідомішою хімічною сполукою, до якої входить дейтерій, є «важка вода» D2О.
У ядерних реакціях утворюється ще один ізотоп Гідрогену — тритій, у ядрі якого 1 протон і 2 нейтрони. Тритій (хімічний символ Т). радіоактивний і в природі не трапляється.
Таким чином, найбільш відомі три ізотопи Гідрогену: 11Н (або просто Н), 12H (або D), 13Н (або Т). Останнім часом також добуті важчі ізотопи Гідрогену з масою від 4 до 8.