 |
|
Примеры решения задач
Пример 1. Определите значения эквивалента и эквивалентной массы для веществ: O2, Ca, H2SO4, Mg(OH)2, Al2(SO4)3.
Решение. 1 моль атомов кислорода способен соединиться с двумя молями атомов водорода, следовательно, на один моль атомов водорода приходится 1/2 моля атомов кислорода. Тогда, по определению эквивалента Э(О) = 1/2.
Молекула О2 состоит из двух атомов кислорода, следовательно, на 1 моль молекул О2 приходится 4 моль атомов водорода. Тогда Э(О2) = 1/4.
МЭ(О) = 1/432 = 8 г/моль.
Проведя аналогичные рассуждения и расчеты, получим:
| Са | H2SO4 | Mg(OH)2 | Al2(SO4)3 | |
| Э | 1/2 | 1/2 | 1/2 | 1/6 |
| MЭ, г/моль |
Пример 2.Определите значения эквивалентов, эквивалентных масс и число эквивалентов всех исходных и полученных веществ в реакциях:
1) H2SO4 + NaOH = NaHSO4 + H2O;
2) H2SO4 + 2NaOH = Na2SO4 + 2H2O;
3) 3H2SO4 + 2Al(OH)3 = Al2(SO4)3 + 6H2O.
Решение. 1) В первом уравнении реакции в каждой молекуле H2SO4 лишь один ион Н+ замещается на ион Na+, следовательно: Э(Н2SO4)= 1;
МЭ (H2SO4) = М (Н2SO4) и nЭ = 1моль. Далее, рассуждая аналогично, получим
| Н2SO4 | NaOH | NaHSO4 | H2O | |
| Э | ||||
| MЭ, г/моль | ||||
| nЭ, моль |
2) Во втором уравнении реакции в каждой молекуле H2SO4 два катиона Н+ замещаются на два катиона Na+, следовательно: Э(Н2SO4) = 1/2;
МЭ (Н2SO4)= 1/2 МЭ (Н2SO4) , а в реакции принимает участие 1 моль молекул H2SO4 и 2 моль эквивалентов, т. е. nЭ = 2 моль. Тогда:
| H2SO4 | NaOH | Na2SO4 | H2O | |
| Э | 1/2 | 1/2 | 1/2 | 1/2 |
| MЭ, г/моль | ||||
| nЭ, моль |
Для третьего уравнения реакции получим:
| H2SO4 | Al(OH)3 | Al2(SO4)3 | H2O | |
| Э | 1/2 | 1/3 | 1/6 | |
| MЭ, г/моль | ||||
| nЭ, моль |
Пример 3.
Вычислите объем, занимаемый азотом массой 25 г при температуре 23 ºС и давлении 106 кПа. Каково число молекул в данной массе газа?
Решение:
 |
N2
m = 25г Определяем количество вещества азота
T = 27 0C = 300 K
p = 106 кПа =1,06 ∙ 105 Па 
V−?
 N−?
N−?
Находим объем данного количества газа при нормальных условиях:
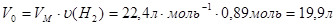
Пользуясь объединенным газовым законом, приводим объем азота к заданным условиям:
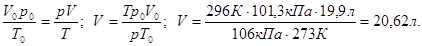
Число структурных частиц (n) рассчитывается с помощью числа Авогадро (NА):

Эту задачу можно также решить используя уравнение Клапейрона − Менделеева:
PV = nRT; n = 25/28 = 0,89 моль;
тогда: V = n RT/ p = 0,89 ∙ 8,31 ∙ 296 / 1,06 ∙ 105 = 1,99 ∙ 10-2 м3 = 20,6 л .
N = NА ∙ n = 6,02 ∙ 1023 ∙ 0,89 ≈ 5,36 ∙ 1023 .
Пример 4.
В гидриде двухвалентного металла содержится 7,65 % водорода (по массе). Определите эквивалентную и молярную массу металла.
Решение.
Содержание металла в этом соединении 100,00-7,65 = 92,35 %.
Следовательно, при образовании 100 г гидрида 92,35 г металла соединяются с 7,65 г водорода. Используя закон эквивалентов, определяем эквивалентную массу металла:
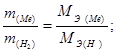

Вычисляем молярную массу металла, зная, что его степень окисления в данном соединении равна плюс двум:

По таблице Д.И. Менделеева находим, что искомый металл Mg.
Пример 5.
Металл массой 1,75 г вытеснил из кислоты 0,7 л водорода (н.у.). Определить эквивалентную массу металла.
Решение. Эквивалентный объем водорода равен:
VЭ (Н2) = 22,4 / 2 = 11,2 л/моль.
Согласно закону эквивалентов:
m (Ме) V(H2)
——— = ——— ;
MЭ(Ме) VЭ(H2)
тогда эквивалентная масса металла:
m(Ме) ∙ Vэ(H2) 1,75 ∙ 11,2
MЭ(Ме) = —————— = —————— = 28 г/моль
V(H2) 0,7
Перебирая возможные значения эквивалента металла (1, ½, 1/3, ¼) получаем, что только Э=½ и М= 56 г/моль соответствует реальному
металлу −Fe.
Пример 6.
В какой массе NaBr содержится столько же эквивалентов, сколько в 123 г Ba(ОН)2?
Решение.
Эквивалентная масса Bа(ОН)2 рассчитывается по формуле:

Следовательно, в 123 г Bа(ОН)2 содержится 123 г : 85,5 г/моль =
= 1,4 моль эквивалентов.
Эквивалентная масса NaBr рассчитывается по формуле расчета эквивалентной массы соли:

Тогда масса NaBr, в которой содержится 1,4 эквивалента:
m(NaBr) 103 г / моль · 1,4 моль = 113,3 г.
Пример 7.
Вычислите массу молекулы угольной кислоты Н2СО3.
Решение.
Моль любого вещества содержит число Авогадро (Na) структурных единиц (в рассматриваемом примере молекул). Молярная масса Н2СО3 равна 62 г/моль. Следовательно, масса одной молекулы
m0 (H2CO3) = 62/(6,02 · 10-23)=1,03 · 10-22г.
Пример 8.
Рассчитайте, каковы массы (в граммах) одной молекулы брома, двух атомов кальция.
Решение.
M(Br2) = 159,81 (г/моль)
NА = 6,02 ∙ 1023 (моль-1)
m0(Br2) =  2,655 ∙ 10-22 (г)
2,655 ∙ 10-22 (г)
M(Ca) = 40,08 (г/моль)
m0(Ca) =  6,658 ∙ 10-23 (г)
6,658 ∙ 10-23 (г)
2 ∙ m0 (Ca)  1,332 ∙ 10-22 (г)
1,332 ∙ 10-22 (г)
Ответ: m(Br2)  2,655 ∙ 10-22 (г)
2,655 ∙ 10-22 (г)
m(Ca)  1,332 ∙ 10-22 (г)
1,332 ∙ 10-22 (г)
Полные условия задач, которые будут предложены на модульной контрольной работе!
1. Определите эквивалент и эквивалентную массу фосфора, кислорода и брома в соединениях РНз, Н2О, НВг.
2. Выразите в молях: а) 6,02 ◦ 10 22 молекул C2H2: б) 1,80 ◦ 1024 атомов азота; в) 3,01 ◦ 1023 молекул NНз. Какова мольная масса указанных веществ?
3. Чему равен при н.у. эквивалентный объем водорода? Вычислите эквивалентную массу металла, если на восстановление 1,017 г его оксида израсходовалось 0,28 л водорода (н.у)
4. При нормальных условиях оксид азота массой 150 г занимает объем
112 л. Определите формулу данного оксида азота.
5. Чему равен при н.у. эквивалентный объем кислорода? На сжигание 1,5 г двухвалентного металла требуется 0,69 л кислорода (н.у.). Вычислите эквивалентную массу, мольную массу и атомную массу этого металла.
6. Какой объем займет при температуре 27 °С и давлении 150 кПа газообразный хлор массой 142 г?
7. В каком количестве Сг(ОН)3 содержится столько же эквивалентов, сколько в 174,96 г Мg(ОН)2? Ответ: 174 г.
8. Найдите плотность по кислороду газовой смеси, состоящей из азота и оксида углерода (IV), объемные доли которых соответственно равны 60 и 40 %.
9. При взаимодействии 3,24 г трехвалентного металла с кислотой выделяется 4,03 л водорода (н.у.). Вычислите эквивалентную мольную и атомную массы металла.
10. Найдите количество вещества, массу и число молекул НС1, взятых в объеме 78,4·10-3 м3.
11. На нейтрализацию 9,797 г ортофосфорной кислоты израсходовано 7,998 г NаОН. Вычислите эквивалент, эквивалентную массу и основность Н3Р04 в этой реакции. На основании расчета напишите уравнение реакции.
12. Рассчитайте массу 2 л газовой смеси, содержащей (по объему) 30% азота и 70% водорода (н.у.).
13. При окислении 16,74 г двухвалентного металла образовалось 21, 54 г оксида. Вычислите эквивалентные массы металла и его оксида. Чему равны мольная и атомная массы металла?
14. Какой объем займет при температуре 20 °С и давлении 250 кПа газообразный аммиак массой 102 г?
15. На нейтрализацию 0,943 г фосфористой кислоты Н3РО3 израсходовано 1,291 г КОН. Вычислите эквивалент, эквивалентную массу и основность кислоты.
16. Какой из перечисленных ниже газов, легче воздуха: фтор; ацетилен; углекислый газ? Ответ подтвердите соответствующим расчетом.
17. Избытком хлороводородной (соляной) кислоты подействовали на растворы:
а) гидрокарбоната кальция; б) дихлорида гидроксоалюминия. Напишите уравнения реакций этих веществ с НСl и определите их эквиваленты и эквивалентные массы.
18. Исходя из мольной массы углерода и воды, определите абсолютную массу атома углерода и молекулы воды в граммах.
19. В 2,48 г оксида одновалентного металла содержится 1,84 г металла. Вычислите эквивалентные массы металла и его оксида. Чему равна мольная и атомная масса этого металла?
20. Какой объем (н. у.) займет углекислый газ, полученный при разложении 200 г СаСО3?
21. Из 3,31 г нитрата металла получается 2,78 г его хлорида. Вычислите эквивалентную массу этого металла.
22. Масса газа объемом 1,25 л (н. у.) равна 2,46 г. Какова молярная масса данного газа?
23. В какой массе NаОН содержится столько же эквивалентов, сколько в 140 г КОН? Ответ: 100 г.
24. Газообразный оксид азота имеет плотность по кислороду, равную 1,375. Какова формула оксида азота?
25. В 2,48 г оксида одновалентного металла содержится 1,84 г металла. Вычислите эквивалентные массы металла и его оксида. Чему равна мольная и атомная масса этого металла?
26. Плотность некоторого газообразного органического вещества по воздуху равна 1,52. Чему равна плотность этого вещества по водороду?
27. Оксид трехвалентного элемента содержит 31,58 % кислорода. Вычислите эквивалентную, мольную и атомную массы этого элемента.
28. При некоторой температуре плотность паров серы по воздуху равна 6,62. Из скольких атомов состоит молекула серы?
29. Вычислите эквивалентную массу кислоты, если известно, что 2 г этой кислоты содержат 0,1 г водорода, способного замещаться на металл.
30. Какой объем (н. у.) оксида азота (II) образуется при взаимодействии 0,51021 молекул газообразного азота с кислородом?
31. Эквивалентная масса металла составляет 28 г/моль. Определите объем водорода, выделившегося в результате реакции 11,2 г данного металла с избытком кислоты (н. у.).
32. Какой из приведенных ниже газов, взятый массой 1,5 г, занимает при н.у. объем 1,12 л?
а) СН4; б) С2Н6; в) C3H8.
33. Эквивалентная масса металла составляет 28 г/моль. Определите объем водорода, выделившегося в результате реакции 11,2 г данного металла с избытком кислоты (н. у.).
34. Какой объем займет при температуре 20 °С и давлении 250 кПа газообразный аммиак массой 102 г?