 |
|
Амперометрическое титрование
Вольтамперометрия
Вольтамперометрия - совокупность электрохимических методов исследования и анализа, основанных на изучении зависимости силы тока в электролитической ячейке от потенциала погруженного в анализируемый р-р индикаторного микроэлектрода, на котором реагирует исследуемое электрохимически активное (электроактивное) в-во. В ячейку помещают помимо индикаторного вспомогательный электрод со значительно большей поверхностью, чтобы при прохождении тока его потенциал практически не менялся (неполяризующийся электрод). Разность потенциалов индикаторного и вспомогат. электродов Е описывается ур-нием Е = U — IR, где U - поляризующее напряжение, R-сопротивление р-ра. В анализируемый р-р вводят в большой концентрации индифферентный электролит (фон), чтобы, во-первых, уменьшить величину R и, во-вторых, исключить миграционный ток, вызываемый действием электрического поля на электроактивные в-ва. При низких концентрациях этих в-в омическое падение напряжения IR в р-ре очень мало. Для полной компенсации омического падения напряжения применяют потенциостатирование и трехэлектродные ячейки, содержащие дополнительно электрод сравнения.
В качестве индикаторных микроэлектродов используют стационарные и вращающиеся - из металла (ртуть, серебро, золото, платина), углеродных материалов (напр., графит), а также капающие электроды (из ртути, амальгам, галлия). Последние представляют собой капилляры, из которых по каплям вытекает жидкий металл. Вольтамперометрия с использованием капающих электродов, потенциал которых меняется медленно и линейно, наз. полярографией. Электродами сравнения служат обычно электроды второго рода, напр. каломельный или хлоросеребряный.
Циклическая вольтамперометрия (вольтамперометрия с относительно быстрой треугольной разверткой потенциала) позволяет изучать кинетику и механизм электродных процессов путем наблюдения на экране осциллографической трубки с послесвечением одновременно вольтамперограмм с анодной и катодной разверткой потенциала, отражающих, в частности, и электрохимические р-ции продуктов электролиза.
Нижняя граница определяемых концентраций Сн в методах вольтамперометрии с линейной разверткой потенциала составляет 10-5-10-6 М. Для ее снижения до 10-7-10-8 М используют усовершенствованные инструментальные варианты - переменно-токовую и дифференциальную импульсную вольтамперометрию.
В первом из этих вариантов на постоянную составляющую напряжения поляризации налагают переменную составляющую небольшой амплитуды синусоидальной, прямоугольной (квадратноволновая вольтамперометрия), трапециевидной или треугольной формы с частотой обычно в интервале 20-225 Гц. Во втором варианте на постоянную составляющую напряжения поляризации налагают импульсы напряжения одинаковой величины (2-100 мВ) длительностью 4-80 мс с частотой, равной частоте капания ртутного капающего электрода, или с частотой 0,3-1,0 Гц при использовании стационарных электродов. В обоих вариантах регистрируют зависимость от U или Е переменной составляющей тока с фазовой или временной селекцией. Вольтамперограммы при этом имеют вид первой производной обычной вольтамперометрич. волны. Высота пика на них пропорциональна концентрации электроактивного в-ва, а потенциал пика служит для идентификации этого в-ва по справочным данным.
Для всех вариантов вольтамперометрии используют способ снижения Сн, основанный на предварительном электрохимическом, адсорбц. или хим. накоплении определяемого компонента р-ра на поверхности или в объеме стационарного микроэлектрода, с последующей регистрацией вольтамперограммы, отражающей электрохимическую реакцию продукта накопления. Эту разновидность вольтамперометрии называют инверсионной. В инверсионной вольтамперометрии с предварит. накоплением Сн достигает 10-9-10-11 М. Минимальные значения Сн получают, используя тонкопленочные ртутные индикаторные электроды, в т.ч. ртутно-графитовые, состоящие из мельчайших капелек ртути, электролитически выделенных на подложку из специально обработанного графита.
Для фазового и элементного анализа твердых тел используют инверсионную вольтамперометрию с электроактивными угольными электродами (т. наз. минерально-угольными пастовыми электродами). Их готовят из смеси угольного порошка, исследуемого порошкообразного в-ва и инертного связующего, напр. вазелинового масла. Разработан вариант этого метода, который дает возможность проводить анализ и определять толщину металлических покрытий. В этом случае используют специальное устройство (прижимная ячейка), позволяющее регистрировать вольтамперограмму, пользуясь каплей фонового электролита, нанесенного на исследуемую пов-сть.
Вольтамперометрию применяют: для количественного анализа неорганических и органических в-в в очень широком интервале содержаний - от 10-10 % до десятков %; для исследования кинетики и механизма электродных процессов, включая стадию переноса электрона, предшествующие и последующие химической р-ции, адсорбцию исходных продуктов и продуктов электрохимических реакций и т. п.; для изучения строения двойного электрического слоя, равновесия комплексообразования в растворе, образования и диссоциации интерметаллических соединений в ртути и на поверхности твердых электродов; для выбора условий ампераметрического титрования и др.
ВОЛЬТАМПЕРОМЕТРИЯ
Вольтамперометрический метод анализа основан на изучении поляризационных или вольтамперных кривых (вольтамперограмм) – зависимостей силы тока от приложенного напряжения. Вольтамперограммы регистрируют в электролитической ячейке с помощью поляризуемого индикаторного электрода и неполяризуемого электрода сравнения, погруженных в анализируемый раствор. На легкополяризуемом микроэлектроде происходит электровосстановление или электроокисление вещества (деполяризатора).
В настоящее время существует несколько десятков разновидностей вольтамперометрии, способных обеспечить экспрессность, высокую чувствительность, избирательность при определении неорганических и органических веществ в самых разнообразных объектах.
В классическом полярографическом методе в качестве рабочего электрода используют ртутный капающий электрод (ртуть вытекает из тонкого капилляра), электродом сравнения служит насыщенный каломельный электрод или донная ртуть. Если в растворе присутствуют вещества, способные электрохимически восстанавливаться или окисляться (так называемые деполяризаторы), то при наложении на электрохимическую ячейку линейно-меняющегося потенциала регистрируется вольтамперная кривая в виде волны (рис. 1.3).
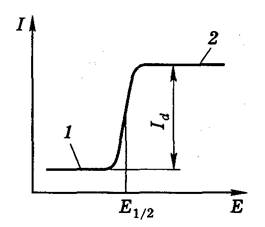
Рис.1.3. Классическая полярограмма:
1 – остаточный ток,
2 – диффузионный ток
При низких значениях потенциала (участок 1 на рис.1.3), величина которого не достаточна для того, чтобы на рабочем микроэлектроде проходила электрохимическая реакция, через ячейку проходит очень незначительный остаточный ток. Остаточный ток обусловлен прежде всего током заряжения двойного электрического слоя, который образуют ионы раствора на катоде, когда потенциал электрода недостаточен для их разряда, и присутствием в растворе более электрохимически активных, чем определяемое вещество, примесей.
При увеличении потенциала электрохимически активное вещество – деполяризатор вступает в электрохимическую реакцию на электроде, например,
Cd2+ + 2 е + Hg  Cd (Hg)
Cd (Hg)
и в результате этого ток резко возрастает. Это так называемый фарадеевский ток. С ростом потенциала ток возрастает до некоторого предельного значения, оставаясь затем постоянным (участок 2). Предельный ток обусловлен тем, что в данной области потенциалов практически весь деполяризатор из приэлектродного слоя исчерпан в результате электрохимической реакции, а обедненный слой обогащается за счет диффузии деполяризатора из объема раствора. Скорость диффузии деполяризатора в этих условиях контролирует скорость электрохимического процесса в целом, и ток перестает зависеть от наложенного напряжения. Такой ток называют предельным диффузионным.
Для того, чтобы исключить электростатическое перемещение деполяризатора (миграцию) в поле электродов и понизить сопротивление ячейки, измерения проводят в присутствии большого избытка сильного электролита, называемого фоновым или фоном. Являясь электрохимически индифферентным, он не принимает участия в электродной реакции, но его ионы экранируют электрод, уменьшая тем самым движущую силу миграции под действием электрического поля практически до нуля.
Полярограмма содержит ценную аналитическую информацию: качественной характеристикой деполяризатора является потенциал полуволны(Е1/2) – потенциал, при котором ток равен половине величины диффузионного тока. Потенциал полуволны Е1/2 не зависит от силы тока и концентрации восстанавливающегося иона, зависит от его природы. Определение Е1/2составляет основу качественного полярографического анализа.
Предельный диффузионный ток (Id)линейно связансконцентрацией деполяризатора в объеме раствора, и эта зависимость является основой количественного полярографического анализа. Связь Id с концентрацией иона См выражается уравнением Ильковича:

где: п – заряд иона; D – коэффициент диффузии, см2·сˉ1; т – скорость вытекания ртути, мг·сˉ1; t – время образования капли (период капания), с; CM – концентрация деполяризатора, ммоль/л; Id – ток, мкА.
Если в растворе находится несколько электрохимически активных соединений, на полярограмме будет не одна волна, а несколько ‑ по числу восстанавливающихся ионов (рис. 1.4.). Можно получить полярографический спектр ионов и затем по измеренному Е1/2идентифицировать неизвестное вещество.
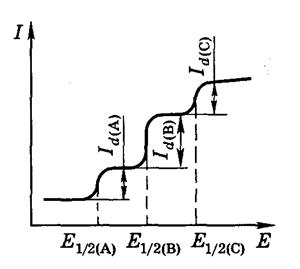
Рис. 1.4. Полярограмма при наличии
в растворе восстанавливающихся
веществ А, В и С
Для определения концентрации используют метод сравнения со стандартом, метод градуировочного графика и метод добавок.
Амперометрическое титрование
Полярографический метод можно применить для определения точки эквивалентности в титриметрических методах анализа, если хотя бы один из участников реакции или ее продукт электроактивны - окисляются или восстанавливаются на микроэлектроде. Это так называемый метод амперометрического титрования. Титрование проводят при заданном значении потенциала, соответствующем достижению предельного диффузионного тока. Связь между вольтамперными кривыми и кривой зависимости предельного тока от объема титранта представлена на рис. 1.5.
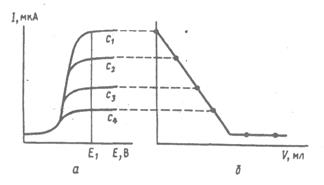
Рис. 1.5. Вольтамперограммы электроактивного вещества при концентрациях с1>c2>c3>c4 (а), кривая амперометрического титрования этого вещества при потенциале индикаторного электрода E1 (б)
В ходе амперометрического титрования регистрируют величину диффузионного тока в зависимости от объема добавленного титранта. Кривая амперометрического титрования в координатах: сила тока ‑ объем титранта (Id ‑ V) состоит из двух линейных участков, точку эквивалентности находят графически. В качестве индикаторных электродов в амперометрическом титровании обычно применяют платиновые, графитовые и другие твердые электроды, чаще всего вращающиеся.
Следует различать электрохимическую реакцию, протекающую на границе раздела фаз электрод-раствор, и химическую реакцию, протекающую в растворе между определяемым веществом и титрантом.
Вид кривой амперометрического титрования зависит от того, какой компонент химической реакции участвует в электродном процессе (является деполяризатором): определяемое вещество, титрант или продукт реакции. На рис. 1.6 представлены основные типы кривых амперометрического титрования, в таблице 1 приведены примеры титрования.
а) определяемое вещество электрохимически активно
До точки эквивалентности уменьшается концентрация определяемого вещества в растворе, диффузионный ток падает.
б) титрант электрохимически активен
Концентрация электрохимически активного титранта в растворе увеличивается после достижения точки эквивалентности; это приводит к возрастанию силы тока Id.

Рис.1.6.Виды кривых амперометрического титрования:
а) деполяризатор - определяемое вещество;
б) деполяризатор - титрант;
в) деполяризаторы -
определяемое вещество и титрант;
г) деполяризатор -
продукт реакции
в) определяемое вещество и титрант электрохимически активны
До точки эквивалентности диффузионный ток уменьшается с уменьшением концентрации определяемого вещества. После точки эквивалентности диффузионный ток возрастает с увеличением концентрации титранта в растворе.
г) продукт химической реакции электрохимически активен
В ходе химической реакции образуется продукт, концентрация которого возрастает до точки эквивалентности, после чего остается постоянной. Диффузионный ток возрастает до точки эквивалентности.
Таблица 1. Тип кривой в зависимости от условий амперометрического титрования
| Тип кривой, (рис.1.6) | Химическая реакция | Электрохимическая реакция | Участник химической реакции - деполяризатор |
| а | Ag+ +I- → AgI↓ | Ag+ + e- → Ag0 | Определяемое вещество Ag+ |
| б | Ag+ +I- → AgI↓ | I- + e- → ½ I2 | Титрант I- |
| в | 2 Pb2+ + Сr2О7 2‾ + Н2О → 2 РbCrO4 ↓+ 2 Н+ | Рb2+ + 2 е- → Pb0 Сr2О72‾ + 14 Н+ + 6 е-→ 2 Сr3+ + 7 Н2О | Определяемое вещество Рb2+ и титрант Сr2О7 2‾ |
| г | AsO43‾ + 2 I‾ + 2Н+ → AsO32‾ +I2 + Н2О | I2 + 2 e- → 2I‾ | Продукт I2 |
В методах амперометрического титрования используют реакции осаждения, комплексообразования и окисления ‑ восстановления. Многие анионы: Сl‾, Вr‾, I‾, SO42‾, МоO42‾ и др. титруются солью свинца, при этом регистрируется ток восстановления Рb2+ на ртутном капающем электроде.
В реакциях осаждения часто применяется осаждение органическими реагентами: 8-оксихинолином, купфероном, диметилглиоксимом и др., причем титрование можно проводить как по току восстановления катиона, так и по току органического реагента.
Широко используется в амперометрическом титровании реакция образования этилендиаминтетраацетатных комплексов с различными катионами: Bi3+, Fe3+, Fe2+, Ni2+, Pb2+, Zn2+, Cu2+, Co2+, Cd2+.
При амперометрическом титровании с использованием реакций окисления – восстановления в качестве титрантов используют К2Сr2О7; Ce(SO4)2; КBrO3 и I2 для определения восстановителей; FeSO4, Na2S2O3 – для определения окислителей.