 |
|
Молекулярная физика. Свойства газов и жидкостей.
| Обозн. | Изм. | Смысл |
| p | Па | давление |
| V | м3 | объем |
| T | К | температура |
| N | – | число молекул |
| m | кг | масса |

| кг/Моль | молярная масса |

| Моль | кол-во вещества |
| U | Дж | вн. энергия газа |
| Q | Дж | кол-во теплоты |
| – | КПД |
Уравнение состояния.
pV=NkT - уравнение состояния (уравнение Менделеева- Клайперона)
 ,
,  ,
, 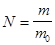 ;
;
 ,
,  - полная внутренняя энергия системы.
- полная внутренняя энергия системы.
| Число атомов | i | 
|
| 5/3 | ||
| 9/7 | ||
| 13 (12) | 15/13 (7/6) |
 - основное уравнение молекулярно- кинетической теории.
- основное уравнение молекулярно- кинетической теории.
 - закон Дальтона для давления смеси газов.
- закон Дальтона для давления смеси газов.
 , p=nkT ;
, p=nkT ;
при N=const 
| T=const | изотерма | PV=const | закон Бойля-Мариотта |
| p=const | изобара | V/T=const | закон Гей-Люсака |
| V=const | изохора | p/T=const | закон Шарля |
Броуновское движение.
 среднеквадратичная скорость молекул.
среднеквадратичная скорость молекул.
 - наиболее вероятная скорость молекул.
- наиболее вероятная скорость молекул.
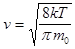 - средняя арифметическая скорость молекул.
- средняя арифметическая скорость молекул.
 - Закон Максвелла для распределения молекул идеального газа по скоростям.
- Закон Максвелла для распределения молекул идеального газа по скоростям.
Среднее число соударений молекулы за 1с: 
Средняя длинна свободного пробега молекул 
 - средний путь молекулы за время t.
- средний путь молекулы за время t.
Распределение в потенциальном поле.
 - барометрическая формула.
- барометрическая формула.
 - распределение Больцмана.
- распределение Больцмана.
Термодинамика.
 - первое начало термодинамики.
- первое начало термодинамики.
 - работа газа.
- работа газа.
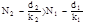 - уравнение адиабаты.
- уравнение адиабаты.
Теплоемкость  , удельная теплоемкость с=С/m.
, удельная теплоемкость с=С/m.
| Название | Опред. | Уравнение | A | Q | C |
| Изохора | V=const | Q=U | 0 | NkT/(-1) | Nk/(-1) |
| Изобара | p=const | U=Q+pV | pV | pV/(-1) | Nk/(-1) |
| Изотерма | T=const | Q=A | 
| A | |
| Адиабата | Q=const | U=-A | 
| 0 | 0 |
Тепловой баланс.
Qотд=Qполуч
Q=cmT - теплота на нагрев (охлаждение)
Q=rm - Теплота парообразования (конденсации)
Q=m - плавление (кристаллизация)
Q=qm - сгорание.
Тепловое расширение.
l=l0(1+T) V=V0(1+T)
Тепловые машины.
 - коэффициент полезного действия
- коэффициент полезного действия
 ,
, 