 |
|
Взаимодействие солей магния с оксихинолином
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО РЫБОЛОВСТВУ
БАЛТИЙСКАЯ ГОСУДАРСТВЕННАЯ АКАДЕМИЯ
РЫБОПРОМЫСЛОВОГО ФЛОТА
ЭЛЕМЕНТЫ II ГРУППЫ ГЛАВНОЙ ПОДГРУППЫ ПЕРИОДИЧЕСКОЙ СИСТЕМЫ Д.И. МЕНДЕЛЕЕВА
Методические указания к лабораторной работе по курсу «Химия» для студентов специальности 280700.62
Калининград
Опыт №1
Получение гидроксида магния и его растворение в кислоте, солях аммония
Едкие щелочи образуют с ионами магния Mg2+ белый аморфный осадок Mg(OH)2:
Mg2+ + 20Н- = Mg(OH)2
Гидроокись магния растворима в кислотах и солях аммония.
В пробирку с раствором соли магния прибавлять по каплям раствор щелочи до образования осадка. Осадок разделить на три части и поместить в пробирки.В первую прибавлять по каплям концентрированный раствор щелочи, во вторую — концентрированную соляную кислоту, в третью — насыщенный раствор хлорида аммония NH4CI. В каких пробирках наблюдалось растворение осадка? О каких свойствах это свидетельствует?
Написать соответствующие уравнения реакций.
Опыт №2
Взаимодействие солей магния с гидрофосфатом натрия Na2HP04
Гидрофосфат натрия Na2HP04 образует с солями магния в присутствии NH4OH и NH4Cl белый кристаллический осадок фосфата магния и аммония MgNH4P04:
Mg2+ + НРО42- + NH4OH = MgNH4P04 + Н20
Соль аммония прибавляют для того, чтобы при действии аммиака не образовался осадок Mg(OH)2.Выполнять эту реакцию лучше в кислом растворе, постепенно понижая его кислотность прибавляемым по каплям NH4OH. Растворимость MgNH4P04 при этом будет постепенно уменьшаться и тем самым будут созданы условия для медленной кристаллизации, способствующие образованию хорошего, явственно кристаллического осадка.
Для получения правильно образованных кристаллов MgNH4P04 реакцию следует проводить, соблюдая определенные условия.
Смешивают в пробирке 1-2 капли раствора соли магния с 2-3 каплями 2 н. раствора НСl и 1-2 каплями раствора Na2HP04. После этого прибавляют к раствору по одной капле 2 н. раствор NH4OH, перемешивая содержимое пробирки после добавления каждой капли. Сначала аммиак нейтрализует кислоту с образованием NH4CI, нужным для предупреждения выпадения в осадок Mg(OH)2. Когда нейтрализация закончится, начинается выпадение характерного кристаллического осадка MgNH4PO4. Прибавление аммиака необходимо продолжать до явственного запаха или до слабощелочной реакции по фенолфталеину (розовая окраска бумаги, отвечающая рН= 9). Сильнощелочной реакции следует избегать, так как при рН > 10 вместо MgNH4P04 выпадает малохарактерный осадок Mg3(PO4)2. Из разбавленных растворов осадок выпадает не сразу. Трение стенок пробирки стеклянной палочкой ускоряет его образование.
Осадок разделить на три части и поместить в пробирки. В первую прибавлять по каплям концентрированный раствор щелочи, во вторую — концентрированную соляную кислоту, в третью — раствор уксусной кислоты СН3СООН.
В каких пробирках наблюдалось растворение осадка? О каких свойствах это свидетельствует? Написать соответствующие уравнения реакций.
Опыт №3
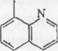
Взаимодействие солей магния с оксихинолином
C9H6ON
ОксихинолинC9H6ON образует с аммиачным раствором солей магния зеленовато-желтый кристаллический осадок оксихинолината магния Mg(C9H6ON)2, представляющий собой малорастворимое внутрикомплексное соединение.
| Рис. 1 |
Структурная формула оксихинолина (рис. 1):
ОН
|
Для выполнения реакции к капле раствора соли магния прибавляют по капле растворы NH4Cl и NH4OH и действуют каплей 5%-ного спиртового или аммиачного раствора оксихинолина. Реакцию следует выполнять при нагревании во избежание выпадения в осадок самого оксихинолина (это часто имеет место при добавлении спиртового раствора оксихинолина к водному раствору соли магния).
Опыт №4