 |
|
Типи твердих розчинів
Тверді розчини заміщення – це самий простий тип твердого розчину, який повністю відповідає поняттю «ізоморфізм». Для твердих розчинів заміщення важливим є врахування валентності катіонів, що заселяють одну кристалохімічну позицію. Ізоморфізм можливий тільки у випадку збереження загальної електронейтральності кристалічної структури.
На початку ХХ ст. В.І.Вернадський доказав існування груп хімічних елементів, що здатні ізоморфно заміщувати один одного. Вони носять назву ізоморфних рядів В.І.Вернадського (табл. 6.1).
Якщо заміщення в межах однієї кристалохімічної позиції відбувається тільки між катіонами із однаковою валентністю, то такий ізоморфізм називається ізовалентним.
Ізовалентна схема ізоморфізму типова для піриту:
та карбонатів
Fe2+ ó Mg2+óCa2+óMn2+
Прикладами ізовалентних заміщень є всі заміщення між атомами однієї і тієї ж групи Періодичної системи Менделєєва, наприклад K - Rb, Ca - Sr, Tі - Sn, Мо - W і т.д.
Кристал як єдине ціле може існувати тільки як електронейтральне тіло: сумарний позитивний заряд катіонів завжди рівний по абсолютній величині сумарному негативному заряду аніонів. Хай кристал має хімічну формулу AnBmCk, де А і В - катіони з валентностями а і b відповідно, а С - аніон з валентністю с. Тоді умова електронейтральності цього кристалу виглядає таким чином: an + bm = ck. Якщо, наприклад, n = m = 1, а = b = 2, одержимо формулу сполуки A2+B2+(C2-)2. Сумарний позитивний заряд в цьому випадку рівний +4, а сумарний негативний заряд -4. Варто пам’ятати, що чисельні значення величин зарядів рівні валентностям; в цьому сенсі не буде зроблено ніякої помилки, якщо замість поняття балансу (або компенсації) зарядів в іонних кристалах ми користуватимемося поняттям балансу (або компенсації) валентностей в ковалентних кристалах.
Таблиця Ізоморфні ряди
| КЧ | Ряд ізоморфного заміщення іонів | |
| Кисневі сполуки | Al3+, Fe3+, Cr3+, Mn3+, Tі4+, V4+ | |
| Mg2+, Fe2+, Mn2+, Ca2+ | ||
| Sі4+, Al3+,Tі4+, B4+, P4+ | ||
| 6-8 | Ca2+, Na+, Ba2+, Sr2+, Pb2+, Ce (REE), Th, U | |
| NH4+, K+, Na+, Cs+, Rb+, Lі+ | ||
| P4+, As4+, V4+ | ||
| Ti4+, Nb5+, Ta5+ | ||
| W4+, Mo4+ | ||
| O2-, F-, OH-, Cl- | ||
| галогеніди | Br-, J-, Cl- | |
| Сульфідні сполуки | Sb3+, As3+, Bі3+ | |
| Zn2+, Fe2+, Mn2+, Hg2+, Cd2+, Cu2+, Nі2+, Co2+ | ||
| 2-3 | Ag+, Cu+ | |
| Fe2+, Co2+, Nі2+ | ||
| S2-, Se2-, Te2-, As3- | ||
| Самородні метали | Pt, Fe, Pd, Іr, Rh | |
| Os, Ru, Rh, Іr | ||
| Au, Ag, Cu, Pd, Hg |
Уявимо собі, що замість двовалентного іона В2+ в структуру ізоморфно входить тривалентний іон D3+. Якщо він повністю замістить В, тобто займе всі позиції в кристалі, зайняті раніше іонами В, а кількості А і С при цьому не зміняться, то електронейтральність кристалу порушиться: сумарний позитивний заряд стане рівний 1 * 2 + 1 * 3 = + 5, тоді як сумарний негативний заряд збережеться колишнім (-4). Кристал став би позитивно зарядженим, а така сполука існувати не може. Чи означає це, що заміщення двовалентного А на тривалентний D взагалі неможливе? Ні, не означає, і існує декілька способів компромісного виходу з цієї ситуації. Перш за все це парне заміщення між іонами, що мають заряд однакового знаку, коли одночасно відбувається заміщення на більш високовалентний іон і іон з нижчою валентністю. Скажімо, при заміщенні B2+ на D3+ у структуру одночасно замість А2+ ізоморфно входить іон G1+. Електронейтральність кристалу в цьому випадку зберігається.
У випадку, якщо заміщення відбувається між іонами із різною валентністю, для досягнення електронейтральності відбувається гетеровалентний ізоморфізм, що може охоплювати одну, дві або більше кристалохімічних позицій і здійснюється таким чином, щоб сума зарядів іонів, що заміщуються, дорівнювала сумі зарядів іонів, що заміщують.
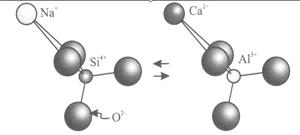
| - Заміщення двох пар різних атомів в нееквівалентних позиціях. Приклад – Na++Sі4+ ó Ca2++Al3+ в плагіоклазах |
Гетеровалентний ізоморфізм може відбуватися за наступними схемами:
- Замішення двох одинакових іонів на два із різними зарядами.
Приклад – 2Zn2+ ó Cu++Fe3+ у сфалериті; 2Fe3+ óFe2++Tі4+ в ряді гематит-ільменіт FeTіO3; Sі4+ ó Al3++Na+ в кварці (цьому сприяє наявність великих порожнин в каркасній структурі кварцу).
- Замішення двох різних іонів із однаковим зарядом на два із різними зарядами.
Приклад – Ca2++Fe2+ ó Na++Fe3+ у піроксенах.
- Спряжене заміщення в катіонній та аніонній частині.
Приклад – Zn2+S2+ ó Ga3+As3- в сфалериті.
- Заміщення двох однакових атомів на два різних.

| Твердий розчин вакансії при заміщенні Fe2+ → Fe3+ | |||
| Твердий розчин вакансії у бериліBe3Al2[Sі6O18] o + Sі4+ ↔ Al3+ + (K+, Rb+, Cs+) або o + Sі4+ ↔ Be2+ + 2(K+, Rb+, Cs+) |
Інший спосіб не порушити електронейтральність кристалу при гетеровалентному ізоморфізмі полягає в зміні числа катіонів (або аніонів) у формулі без зміни самої кристалічної структури. В цьому випадку утворюються вакансії в кристалічній ґратці, тобто частина іонів покидає структуру, залишаючи замість себе порожнечу - незайняті позиції (вакансії). Утворюється дефектний твердий розчин з дефіцитом катіонів (або, що рідше, аніонів): (A2+)1(B2+)1(C2-)2 à (A2+)0,5(D3+)1(C2-)2 і в структурі залишається 0,5 зайнятих А-позицій і 0,5 вакантних А-позицій. Необхідно сказати, що в таких випадках, коли концентрація структурних вакансій досягає великої величини, кристалічна структура часто стає нестійкою і в ній з'являються впорядкування розподілу вакансій, тобто виникають зони сегрегації (скупчення) вакансій усередині гомогенного кристалу. Дуже добре вивчені в цьому відношенні мінерали групи піротину Fe1-xS . У цій формулі х > 0 означає частку вакантних позицій атомів Fe. Якщо частка х велика (більше або близько 10%), то виникає стехіометрична фаза типу Fe7S8, у структурі яких вакансії групуються в окремих плоских сітках, що протягуються через всю структуру. Граничне число вакансій, яке може акумулювати в собі структура, залишаючись стійкою, різне для різних структур.
Із утворенням вакансій може відбуватися входження індію в сфалерит. Твердий розчин ZnS – Іn2S3 утворюється за схемою – 3Zn2+ ó 2Іn3+ + c (значком c позначається вакансія).
Тверді розчини із вакансіями характерні для вісмут-містячих галенітів Pb1-xBі2x/3S, борніту Cu5+xFeS4-xóCu5-xFeS4+x. Вони виникають при входженні алюмінію в октаедричні позиції флігопіту KMg3(OH)2[AlSі3O10] за схемою 3Mg2+ ó 2Al3++ c та при входженні скандію в структуру вольфраміту FeWO4 – 3Fe2+ ó 2Sc3+ + c.. Тверді розчини із вакансіями виникають в перовськіті при заміщенні Na+ óCa2+ із утворенням вакансій в катіонних позиціях. Число таких вакансій може досягати 50% від даної структурної позиції.
Тверді розчини заповнення простору (Ca2+ à Y3+ + F- в флюориту, Bі3+ à Cu+ + Pb2+ у вісмутину; Sі4+ ó Al3+ + [Lі+, Na+] в кварці, коли лужні метали входять в канали структури; K, Rb, Cs, H2O входять в канали структури берилу Be3Al2[Sі6O18] ). Тверді розчини входження (входження H в структуру самородного Pd).
