 |
|
Класифікація дисперсних систем за агрегатним станом подрібненої речовини або розчинника.
Поняття про розчини.
Демонстрація: в хімічні стакани з водою поміщаємо кухонну сіль, цукор, купрум сульфат (мідний купорос) або калій перманганат, пісок.
Бесіда:
ñ Як змінюється кількість речовини в стакані з водою?
ñ Чому відбувається зміна забарвлення води при додавання кольорових речовин?
ñ Як впливає перемішування на швидкість розчинення речовин?
ñ Чи змінюються властивості води після додавання речовин?
При цьому вода набуває нових властивостей: у неї з'являється смак, колір, змінюється щільність, температура кипіння і інше. Отримана рідина вже не є водою. Це розчин.
Розчин - це однорідна суміш речовин.
Профільтруємо розчини - сіль, цукор, купрум сульфат або калій перманганат - не вдається відділити від води. Ці розчини прозорі і однорідні. Це істинні розчини. Їх основна ознака — однорідність.
При розчиненні піску у воді отримуємо суміш з крупинками речовини, вона непрозора і неоднорідна. Крупинки поступово осідають на дно, тому що пісок не розчиняється. При фільтрації вони залишаються на фільтрі.
При розчиненні речовин відбувається їх подрібнення і розсіювання в об'ємі розчину. Усі розчини інакше називають дисперсними системами. У розчині частинки однієї речовини рівномірно розподілені між частинками іншої.
У розчині завжди міститься розчинник (дисперсійне середовище) і розчинена речовина (дисперсна фаза).
Групова робота:
Роздивиться етикетки мінеральних вод і солодких напоїв, визначте їх якісний і кількісний склад.
Питання для обговорення:
ñ Чи мають розчини постійний хімічний склад?
Суміші речовин з водою.
Залежно від ступеня подрібнення речовин, що змішуються з водою, виділяють декілька видів сумішей:
ñ завись;
ñ колоїдний розчин;
ñ істинний розчин.
Основна відмінність - величина частинок, розподілених у воді.
Самостійна робота з текстом слайда, заповнення таблиці.
| Ознаки порівняння | Зависі | Колоїдні розчини | Істинні розчини |
| Величина часток | 10–7 – 10–5 м невеликі частинки. | 10–9 – 10–7 м скупчення частинок. | Дорівнює розмірам молекул, йонів. |
| Оптичні властивості | Непрозорі, мутні. | Прозорі, розсіюють світло. | Прозорі, світло не розсіюють. |
| Можливість розділення | Завислі частинки не проходять крізь паперовий фільтр. | Завислі частинки проходять крізь паперовий фільтр, але не проходять крізь пергаментний. фільтр | Фільтруванням розділити неможливо. |
| Стійкість | Нестійкі в часі, зважені частки досить швидко осідають на дно або спливають на поверхню. | Відносно стійкі, з часом старіють з утворення осаду. | Стійкі у часі, не старіють, можуть існувати нескінченно довго, якщо не відбувається хімічна реакція. |
Класифікація дисперсних систем за агрегатним станом подрібненої речовини або розчинника.
Запис таблиці у зошиті з поясненням та демонстрацією слайдів з прикладами.
| Дисперсійне середовище | Дисперсійна фаза | ||
| тверда | рідка | газоподібна | |
| тверде | Тверді розчини (сплави металів, скло). | - | Піни. |
| рідке | Зависі, суспензії, золі. | Емульсії (вода та масло, молоко). | Гідрозолі. |
| газоподібне | Аерозолі, дим. | Аерозолі, тумани. | Суміші газів (повітря). |
V. УЗАГАЛЬНЕННЯ ТА СИСТЕМАТИЗАЦІЯ ЗНАНЬ
Бесіда із записаних учнями на початку уроку (актуалізації) питань
ñ Чому річкова, колодязна і тала вода мають різний смак?
ñ Яка з них найбільш чиста з хімічної точки зору?
ñ Від яких домішок у воді можна позбутися фільтруванням, відстоювання, дистиляцією?...
VI. ДОМАШНЄ ЗАВДАННЯ
ñ Опрацювати параграф підручника.
ñ Вивчити визначення.
ñ Додаткове завдання:
◦ У будівництві застосовують так званий цементний розчин. Його компонентами є цемент, пісок і вода. Чи можна назвати цю суміш розчином з наукової точки зору?
◦ Поясніть, чому в інструкціях до лікарських препаратів у формі суспензій та емульсій завжди є вказівка: «Перед вживанням ретельно збовтати».
◦ Чи можна стверджувати, що соки полуниці, чорної смородини є розчинами і містять кілька розчинених речовин?
VII. ПІДСУМКИ УРОКУ
“Відбий питання” (учням кидається м'ячик і задається одне й теж саме питання або речення, що необхідно доповнити): Я уявляю розчин як...?
Оцінювання роботи активних учнів, аргументація оцінок.
Урок 2.
ТЕМА: Розчин та його компоненти: розчинник, розчинена речовина. Вода як розчинник. Будова молекули води, поняття про водневий зв’язок.
МЕТА: продовжити формування знань про розчин, його компоненти; розглянути характеристику одного з найважливіших розчинників — води,її склад, будову молекули, ознайомитися з поняттям водневого зв'язку, його впливом на властивості води; розвивати вміння працювати в колективі, визначати та коригувати свій вплив на думку інших людей, вчитися приймати компромісні рішення.
ОБЛАДНАННЯ ТА РЕАКТИВИ: мультимедійний проектор, водопровід (для демонстрації досліду).
ОСНОВНІ ПОНЯТТЯ: розчин, розчинник, розчинена речовина, диполь, водневий зв'язок.
ТИП УРОКУ: урок здобуття та осмислення нового матеріалу.
ВИД УРОКУ: урок теоретичного дослідження.
ХІД УРОКУ
І. ОРГАНІЗАЦІЙНИЙ ЕТАП
Привітання, перевірка готовності до уроку. Поділ класу на активні центри (учням пропонується витягнути з коробки “смайлик”, в залежності від кольору вони займають своє місце у класі).
ІІ. МОТИВАЦІЯ УЧБОВОЇ ДІЯЛЬНОСТІ
Бесіда:
ñ Яка речовина є найбільш поширеною на Землі?
ñ Які властивості вона має?
ñ Чи часто ми можемо зустріти її у чистому вигляді, чому?
Демонстрація слайдів або фотоматеріалів “Незвичні властивості води”:





Чим на ваш погляд можна пояснити ці унікальні характеристики?
ІІІ. АКТУАЛІЗАЦІЯ ОПОРНИХ ЗНАНЬ
Бесіда-змагання груп.
ñ Які типи зв'язку ви знаєте?
ñ За рахунок чого утворюється зв'язок?
ñ Як утворюється ковалентний зв'язок?
ñ В чому особливість ковалентного полярного зв'язку?
ІV. СПРИЙНЯТТЯ І ОСМИСЛЕННЯ НОВОГО МАТЕРІАЛУ
Кожен з активних центрів класу отримує завдання та літературу, щодо роботи. Їх задачею є презентувати повідомлення з розглянутого питання використовуючи запропоновані слайди, макети яких вони отримують разом з питанням.
І — Будова молекули води (можливий варіант доповіді):
Вода як розчинник має непересічне значення. Здатність води розчиняти найрізноманітніші речовини та її інші унікальні властивості спричинені насамперед хімічним складом і будовою молекули цієї сполуки. Тож розгляньмо особливості будови молекули води. Вам добре відомо, що до її складу входять два атоми Гідрогену й один атом Оксигену. Ви знаєте, що електронегативність Оксигену значно більша за електронегативність Гідрогену. Тому утворені за рахунок спільних електронних пар зв'язки О-Н у молекулі води ковалентні полярні. Вони розміщені під кутом 104,5°, і це спричинює асиметричність структури і виникнення диполя. Що таке диполь і за яких умов молекула є диполем?

Демонстрація досліду:
За допомогою простого досліду можна пересвідчитись у тому, що молекули води полярні: тонка водяна цівка притягується до пластмасового корпусу ручки чи ебонітової палички, наелектризованих тертям.

Під впливом диполів води на поверхні речовин, занурених у неї, міжатомні й міжмолекулярні сили слабшають у 80 разів. Така висока діелектрична проникність з усіх відомих речовин властива тільки воді. Цим пояснюють її здатність бути універсальним розчинником.
ІІ — Утворення водневого зв'язку його вплив на властивості води (можливий варіант доповіді):
Асиметричність розподілу електричних зарядів у молекулах води є причиною утворення між ними так званих водневих зв'язків. З наявністю цих зв'язків пов'язані аномально високі (порівняно з леткими сполуками інших елементів VIA групи періодичної системи) температури кипіння і плавлення води.


Завдяки водневим зв'язкам між молекулами вода виявляє унікальні властивості. Ці міжмолекулярні зв'язки стабілізують нещільну кристалічну структуру льоду. Через особливості будови кристалів льоду його густина менша за густину води у рідкому агрегатному стані. Ця властивість запобігає глюмерзанню водойм.

ІІІ — Розчин, його склад (можливий варіант доповіді):
Розчин - однофазна гомогенна система, яка складається з двох або більше компонентів. Розчин може перебувати у будь-якому агрегатному стані. Чи не найпоширеніші розчинники — рідини.
Розчин цукру у воді.
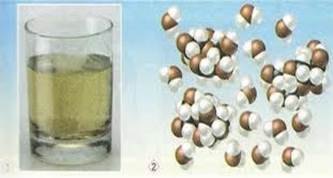
Рідкі розчини використовують у техніці, на виробництві, у сільському господарстві, лабораторних дослідженнях, фармації, медицині і повсякденному житті.
Розчин утворений не менш ніж двома компонентами, один з яких - розчинник, а інші розчинені в ньому. Зазвичай розчинником вважають той компонент, який у чистому вигляді існує у тому самому агрегатному сгані, що й розчин. Якщо компоненти розчину перебувають в одному агрегатному стані, то розчинник - компонент, маса якого у розчині найбільша. Воду традиційно вважають розчинником навіть тоді, коли її маса значно менша за масу розчиненої речовини.
V. УЗАГАЛЬНЕННЯ ТА СИСТЕМАТИЗАЦІЯ ЗНАНЬ
“Аукціон питань” (кожна група складає питання за змістом свого повідомлення, записує їх на стікерах і складає у коробку, вчитель дістаючи листочок з питанням цікавиться у класу кому його задати).
VІ. ПІДСУМКИ УРОКУ.
Продовжити речення:
Я дізнався, що ... .
Я зрозумів, що ... .
Мені знадобляться знання про ... .
Цікавим було ... .
Оцінювання роботи учнів.
VІІ. ДОМАШНЄ ЗАВДАННЯ.
ñ Опрацювати параграф підручника.
ñ Вивчити визначення.
ñ Додаткове завдання:
◦ Які властивості води людина використовує для своїх потреб?
◦ Які наслідки для існування життя мало би зникнення полярності молекули води? Опишіть можливий розвиток подій.
Урок 3.
ТЕМА: Розчинність, фізико-хімічна сутність процесу розчинення, його залежність від різних факторів. Насичені й ненасичені розчини.
МЕТА: ознайомити учнів з розчиненням як фізико-хімічним процесом і розчинами як фізико-хімічними системами, дати класифікацію розчинів, розвивати вміння аналізувати матеріал, робити спостереження та формулювати обґрунтовані висновки, формувати вміння працювати з таблицею розчинності, виховувати прагнення до пізнання навколишнього світу.
ОБЛАДНАННЯ ТА РЕАКТИВИ: роздатковий матеріал-таблиця «Хімічний склад Світового океану і крові людини», таблиця розчинності в підручнику, колекція "Сплави металів", мідний купорос, концентрована сільфатна кислота, кристалічний натрій нітрат, 3 склянки з водою, цукор, термометр длі вимірювання температури води (розчинів).
ОСНОВНІ ПОНЯТТЯ: розчинність, фізико-хімічна сутність процесу розчинення, насичені й ненасичені розчини.
ТИП УРОКУ: комбінований тип уроку.
ВИД УРОКУ: урок теоретичного і експериментального дослідження.
ХІД УРОКУ
І. ОРГАНІЗАЦІЙНИЙ ЕТАП
Привітання. Оголошення теми і мети уроку - ознайомити учнів з розчиненням як фізико-хімічним процесом і розчинами як фізико-хімічними системами. Необхідний інструктаж, організація робочих місць.
Створення “Дерева настрою” (кожен учень заходячи до класу отримує 3 стікера (рожевий, жовтий, синій) у формі листочків (яблук, груш) і в залежності від свого настрою, перед уроком, чіпляє стікер певного кольору на дерево, яке намальовано на дошці або на ватмані (рожевий — гарний настрій, жовтий — спокійний, синій — негативний).
ІІ. ПЕРЕВІРКА ДОМАШНЬОГО ЗАВДАННЯ
Експрес-контроль. (учні отримують картки з тестовими завданнями)
ІІІ. АКТУАЛІЗАЦІЯ ОПОРНИХ ЗНАНЬ
Бесіда.
З розчинами ви зустрічаєтеся в житті неодноразово.
ñ А які ж вам відомі розчини?
ñ Яка роль розчинів у природі та техніці?
У природі і техніці розчини мають величезне значення:
1) Рослини засвоюють речовини у вигляді розчинів.
2) Засвоєння їжі пов'язане з переведенням поживних речовин у розчин.
3) Усі природні води є розчинами.
4) Розчинами є найважливіші фізіологічні рідини - кров, лімфа і т.д.
5)Багато технологічних процесів в хімічній та інших галузях промисловості, наприклад отримання соди, добрив, кислот, металів, паперу, протікають у розчинах.
6)На лабораторних заняттях ви теж працювали в основному з розчинами.
Таким чином, значення розчинів дуже велике.
ІV. СПРИЙНЯТТЯ І ОСМИСЛЕННЯ НОВОГО МАТЕРІАЛУ
Розповідь вчителя.
Особливу роль на нашій планеті відіграє вода. Океан займає 71% поверхні Землі. Великі запаси води на землі створюють враження про її невичерпності. Однак на воду в дійсності в усіх її станах припадає менше 0,001 маси планети, і тільки незначна частина запасів води виявляється доступною і придатною для практичного використання. З всіх рідин вода є найкращим розчинником, володіє найбільшою теплоємністю. Вода входить до складу клітин і тканин будь-якої тварини і рослини. Наприклад, тіло людського триденного зародка на 97% складається з води, тіло дорослої людини - на 60-80%. В огірках, салаті вода становить 95% їх маси, в помідорах, моркві - 90%. Фізіологічну потребу живого організму у воді можна задовольнити тільки водою і нічим іншим. Процес травлення у людини протікає при участі не менше 9-10 л води на добу. Втрати 10-20% води тваринам організмом веде до його смерті.
Відповідно до теорії еволюції життя на землі зародилося у воді. Як доказ цього порівняли хімічний склад деяких розчинених солей морської води і склад людської крові:
Хімічний склад Світового океану і крові людини
| Хімічний елемент. | Частка (у %) від суми розчинних солей. | |
| Вода Світового океану. | Кров людини. | |
| Хлор | 49,3 | |
| Натрій | 30,6 | |
| Оксиген | 5,6 | 9,9 |
| Калій | 1,1 | 1,8 |
| Кальцій | 1,2 | 0,8 |
Завдання (аналіз таблиці).
Порівняйте процентний вміст елементів в крові людини та у воді Світового океану. Який висновок можна зробити?
Постановка проблемного питання.
Як ви вважаєте, процес розчинення це фізичне чи хімічне явище? Поясніть свою точку зору.
А як ви пояснити наступні явища, що відбуваються при розчиненні деяких речовин?
Демонстрація (виконують учні-асистенти).
Дослід 1. Розчинення речовин з виділенням енергії у вигляді тепла (сульфатної кислоти (концентрованої), натрій гідроксиду або цинк сульфату).
Дослід 2. Розчинення речовин з поглинанням енергії (натрій нітрату або калій сульфату).
Дослід 3. Розчинення речовин, що супроводжується зміною кольору (безводного купрум сульфату — білого кольору, який при розчиненні перетворюється на купрум сульфат пентагідрат — блакитного кольору).
Висновок формулюють учні за результатами фронтального обговорення.
Висновок. Відповідно до сучасних поглядів, розчинення - це фізико-хімічний процес, а розчини - це гомогенна система, що складається з частинок розчиненої речовини, розчинника та продуктів їх взаємодії.
Вчитель пояснює, що таке гідрати та кристалогідрати, записує приклади на дошці.
Склад гідратів не постійний в розчинах і постійний в кристалогідратах (CuSO4 ∙ 5H2O; Na2CO3 ∙ H2O).
Кристалізаційна вода - входить до складу молекул кристалогідратів.
Кристалогідрати - це кристалічні речовини, що містять молекули води.
Демонстрація зразків кристалогідратів або слайду:

а) CuSO4 · 5H2O і безводний купрум(ІІ) сульфат;
б) CoCl2 · 6H2O і безводний кобальт(ІІ) хлорид.
Робота з підручником.
Ознайомтесь з розділом “Кристалогідрати” і дайте назви кристалогідратам записаним на дошці.
Бесіда.
Від чого буде залежите розчинність речовин у воді?
Розчинність речовин у воді залежить від температури. Як правило, розчинність твердих речовин у воді збільшується з підвищенням температури, а розчинність газів - зменшується, тому воду можна майже повністю звільнити від розчинених в ній газів кип'ятінням.
Отже, розчинність твердих речовин залежить від:
1) Природи розчиненої речовини
2) Температури
3) Природи розчинника.
Уявіть собі, є 3 склянки: в першій чай не солодкий, у другому підсолоджений, в третьому дуже солодкий, навіть на дні кілька кристаликів цукору не розчинилося.
Який з цих розчинів більш насичений? Відповідь: звичайно, у 3-ій склянці розчин більш насичений.
Так ось, розчини ще діляться по ступеню насиченості.
Складання схеми за принципом пазла (на дошці). Частини схеми розкладені на столі вчителя хаотично.
 | |||||||||
 | |||||||||
 | |||||||||
 | |||||||||
 | |||||||||
Крім того всі речовини можна поділити на 3 групи в залежності від їх розчинності у воді при 200С:
ñ добре розчинні - > 1г (на 100г води при 200С);
ñ мало розчинні - <1 г (на 100г води при 200С);
ñ практично нерозчинні - <0,01 г (на 100г води при 200С).
Бесіда.
ñ Яка таблиця допоможе визначити чи є речовина розчинною у воді?
ñ Як ви користуєтесь нею?
V. УЗАГАЛЬНЕННЯ ТА СИСТЕМАТИЗАЦІЯ ЗНАНЬ
“Відбий питання” (вчитель називає учням речовину, кидає одному з них м'ячик, а учень за таблицею розчинності повинен визначити до якої групи відноситься сполука: розчинна, нерозчинна, малорозчинна). Гру можуть продовжити учні самостійно, кидаючи м'яч один одному.
VІ. ПІДСУМКИ УРОКУ. ОЦІНЮВАННЯ РОБОТИ УЧНІВ.
Учні заповнюють програмовані картки.
Декілька учнів зачитують свої висновки.
Висновок (головне на цьому уроці було...):
1) ...
2) ...
3) ...
4) ...
5) ...
Результат роботи учнів на уроці оцінюється.
Корекція “Дерева настрою”. Вчитель пропанує дітям, у яких протягом уроку змінився настрій поміняти свій стікер на дереві на інший. Вчитель коментує загальний настрій на уроці.
VІІ. ДОМАШНЄ ЗАВДАННЯ
ñ Опрацювати параграф підручника.
ñ Вивчити визначення.
ñ Додаткове завдання:
◦ Яке значення мають знання про розчинність речовин у житті та діяльності людини?
◦ Де і як в побуті людина використовує перенасичені розчини?