 |
|
Приклад 18. У воді масою 200 г розчинили калій гідроксид масою 11,2 г. Густина одержаного розчину становить 1,04 г/мл. Обчисліть молярну концентрацію цього розчину.
Відповідь:
Дано:
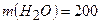 г г
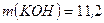 г г
 г/мл г/мл
| Розв’язок:
1. Обчислюємо масу одержаного розчину:
 г
Визначаємо об’єм цього розчину: г
Визначаємо об’єм цього розчину:
 ; ;
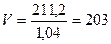 мл=0,203 л. мл=0,203 л.
|
Знайти:
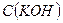 - ? - ?
|
3. Обчислюємо кількість речовини калій гідроксиду , який міститься в розчині:

де  г/моль.
г/моль.
4. Молярна концентрація розчину  визначається:
визначається:
 ;
;
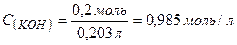
Приклад 19.Який об’єм 2 М розчину NaCl потрібен для одержання 2 л 5%-го розчину густиною 1,05 г/мл.
| Дано: V 5% NaCl = 2 л ρ = 1,05 г/мл | Розв’язок: Обчислюємо масу добутого розчину: m = 2000 ∙ 1,05 = 2100 г Визначаємо масу NaCl у розчині: m = 2100 ∙ 5% = 105 г. Визначаємо кількість речовини NaCl у одержаному розчині: M (NaCl) = 58,5 г/моль, ν (NaCl) = 105 г/58,5г/моль = 1,79 моль. |
| Знайти: V2M NaCl - ? |
Визначаємо об’єм 2М розчину, у якому міститься така кількість NaCl:
V2M = ν (NaCl)/C(NaCl) = 1,79/2 = 0,895 л = 895 мл.
Приклад 20. Як називається добуток концентрацій йонів малорозчинного електроліту у насиченому розчині при певній температурі.
Відповідь:
Для малорозчинної сполуки, яка перебуває у рівновазі зі своїм насиченим розчином, рівняння динамічної рівноваги матиме вигляд
KmAn ↔ mKn+ + nАm-.
Осад Розчин
Згідно закону діючих мас константа рівноваги цієї реакції:

де [KmAn] – концентрація речовини в осаді, яка не залежить від кількості твердої фази. Оскільки [KmAn] = const, то і
K ∙ [KmAn] = const, а отже і [Kn+]m[ Аm-]n = const.
Отже, у насиченому при певній температурі розчині добуток концентрацій йонів малорозчинного електроліту є сталою величиною, яка називається добутком розчинності (ДР). Наприклад, для малорозчинного у воді купрум (ІІ) гідроксиду маємо:
Cu(OH)2 ↔ Cu2+ + 2OH–;
ДР(Cu(OH)2) = [Cu2+][OH–]2 = 6 ∙ 1020.
Значення ДР погано розчинних у воді сполук можна обчислити за їх розчинністю або електропровідністю розчинів. Оскільки ДР сполуки за певної температури є сталою величиною, то збільшення концентрації одного з йонів, на які дисоціює сполука, зменшує концентрацію іншого. Введення однойменних йонів у розчин малорозчинного електроліту знижує його розчинність.
Умови виділення і розчинення осаду:
• якщо [Kn+]m[ Аm-]n < ДР, то розчин ненасичений і осад розчиняється;
• якщо [Kn+]m[ Аm-]n = ДР, то розчин насичений і система перебуває в рівновазі;
• якщо [Kn+]m[ Аm-]n > ДР, то розчин пересичений і відбувається випадання осаду.
Приклад 21. ДР BaF2 при 18 ºС дорівнює 1,7∙10-6. Обчисліть концентрацію йонів Ba2+ i F– у насиченому розчині при даній температурі.
| Дано: ДР (BaF2) = 1,7∙10-6 | Розв’язок: BaF2 ↔ Ba2+ + 2 F– Відповідно до рівняння дисоціації C(F–) = 2 C(Ba2+) Тоді ДР (BaF2) = C(Ba2+) ∙ [2 C(Ba2+)]2 = 4 [C(Ba2+)]3 |
| Знайти: C(Ba2+) - ? C(F-) - ? |

C(F–) = 2 C(Ba2+) = 1,5∙10-2 моль/л
Приклад 22.Змішали 200 мл 0,02 М розчину СаCl2 та 100 мл 0,01 М розчину Na2SO4. Чи випаде осад?
ДР (CaSO4) = 1,3∙10–4.
| Дано: C (CaCl2) = 0,02 M C (Na2SO4) = 0,01 M ДР (CaSO4) = 1,3∙10-4 | Розв’язок: CaCl2 + Na2SO4 = CaSO4 ↓+ 2 NaCl Як було зазначено вище, осад випадатиме, якщо C(Ca2+)∙C(SO42-) > ДР Визначаємо молярні концентрації відповідних йонів у вихідних розчинах: C(Ca2+) = C (CaCl2) = 0,02 моль/л C(SO42-) = C (Na2SO4) = 0,01 моль/л |
| Знайти: Чи випаде осад? |
Визначаємо кількості речовин даних йонів у вихідних розчинах:
ν (Ca2+) = 0,02 моль/л∙0,2 л = 0,004 моль;
ν (SO42-) = 0,01 моль/л∙0,1 л = 0,001 моль.
Визначаємо об’єм одержаного розчину:
V = 0,1 + 0,2 = 0,3 л.
Визначаємо відповідні концентрації у одержаному розчині:
C(Ca2+) = 0,004 моль/0,3 л = 0,013 моль/л;
C(SO42-) = 0,001 моль/0,3 л = 0,003 моль/л.
Визначаємо добуток концентрацій і порівнюємо з ДР:
C(Ca2+)∙C(SO42-) = 0,013 ∙ 0,003 = 4,3∙10-5 < ДР.
Отже, осад не випаде.
Приклад 23. Визначити рН 0,005М розчину Н2SO4.
| Дано: C (Н2SO4) = 0,005 M | Розв’язок: Н2SO4 ↔ 2 Н+ + SO42- рН = -lg [Н+] Визначаємо молярну концентрацію йонів Н+. Оскільки при дисоціації 1 молекули кислоти утворюється 2 йони Н+, то [Н+] = 2 ∙ C (Н2SO4) = = 2 ∙ 0,005 = 0,01 моль/л рН = -lg(0,01) = 2 |
| Знайти: рН – ? |
Приклад 24. Визначити рН 0,001М розчину NaOH.
| Дано: C (NaOH) = 0,001 M | Розв’язок: NaOH ↔ Na+ + OH– рН = -lg [Н+] Визначаємо молярну концентрацію йонів Н+. Оскільки [Н+][ОН-]=10–14, то [Н+] = 10–14/[ОН-]. Концентрація йонів ОН–, згідно рівняння дисоціації, рівна C (NaOH). [ОН–] = C (NaOH) = 0,001 моль/л [Н+] = 10-14/0,001 = 10-11 моль/л рН = -lg(10–11) = 11 |
| Знайти: рН – ? |
Приклад 25. Вкажіть, які з наведених нижче солей гідролізують: а)  , б)
, б)  , в)
, в)  ; г) СН3СООNH4? Для кожної з солей, які гідролізують, напишіть в молекулярній і йонно-молекулярній формах рівняння гідролізу всіх можливих стадій процесу і вкажіть реакцію (рН) водного розчину солі.
; г) СН3СООNH4? Для кожної з солей, які гідролізують, напишіть в молекулярній і йонно-молекулярній формах рівняння гідролізу всіх можливих стадій процесу і вкажіть реакцію (рН) водного розчину солі.
Відповідь:
a) Солі, які є похідними сильних основ і кислот, не гідролізують, оскільки їх йони (катіони і аніони) не зв’язують йони води ( 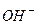 чи
чи 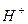 ), а отже, і не зміщують її йонну рівновагу. Тому сіль
), а отже, і не зміщують її йонну рівновагу. Тому сіль  не гідролізує, середовище водного розчину цієї солі є нейтральним (
не гідролізує, середовище водного розчину цієї солі є нейтральним (  ).
).
б) Сіль  утворена слабкою основою і сильною кислотою. Солі такого типу гідролізують з утворенням слабкої основи (якщо це сіль однокислотної основи) або основних солей. Розчини таких солей мають кислу реакцію (
утворена слабкою основою і сильною кислотою. Солі такого типу гідролізують з утворенням слабкої основи (якщо це сіль однокислотної основи) або основних солей. Розчини таких солей мають кислу реакцію ( 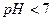 ).
).
І стадія
Молекулярне рівняння:

Йонне рівняння:

Йони 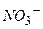 не приймають участі в процесі гідролізу.
не приймають участі в процесі гідролізу.
Скорочене йонне рівняння:
 (
( 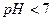 )
)
Як видно, в результаті реакції з’являється надмір водневих йонів, що зумовлює кислий характер розчину. За звичайних умов цей процес протікає в основному по І стадії, але при зміні умов можливий багатостадійний процес (друга та третя стадії).
ІІ стадія


 (
( 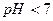 ).
).
ІІІ стадія
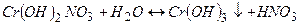
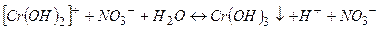
 (
( 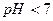 ).
).
в) При гідролізі солі  утворюється деякий надлишок йонів
утворюється деякий надлишок йонів  і тому розчини солей, утворених сильною основою і слабкою кислотою, мають лужну реакцію (
і тому розчини солей, утворених сильною основою і слабкою кислотою, мають лужну реакцію (  ). Реакція протікає постадійно.
). Реакція протікає постадійно.
І стадія


 (
(  )
)
ІІ стадія


 (
(  )
)
г) Розглянемо гідроліз солей, утворених слабкою основою та слабкою кислотою, наприклад, (NH4)2CO3, CH3COONH4, Al2S3.Під час гідролізу амоній ацетату CH3COONH4 ацетат-іони зв’язують йони Н+, утворюючи слабкодисоційовану оцтову кислоту CH3COOH; амоній-іони NH 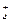 зв’язують йони ОН− утворюючи слабку основу – амоній гідроксид NH4OH:
зв’язують йони ОН− утворюючи слабку основу – амоній гідроксид NH4OH:
CH3COONH4 +H2O↔ NH4OH+CH3COOH
CH3COO−+ NH 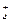 ↔ CH3COOH+ NH4OH
↔ CH3COOH+ NH4OH
Реакція розчину залежить від константи дисоціації продуктів гідролізу – основи та кислоти. В даному випадку константи дисоціації NH4OH і CH3COOH приблизно рівні. Тому реакція розчину є нейтральною.
Солі слабкої основи та слабкої кислоти підлягають гідролізу, реакція розчину залежить від співвідношення констант дисоціації продуктів гідролізу.
Стан рівноваги реакції гідролізу характеризується ступенем гідролізу β, що дорівнює відношенню концентрації тієї частини солі, яка вступила в реакцію гідролізу Сгідр, до загальної концентрації розчиненої солі (C):
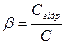
Ступінь гідролізу залежить насамперед від природи розчиненої солі: чим слабкіші кислота і основа, що утворили сіль, тим сильніше відбувається зв'язування йонів H+ і OH− з відповідними ионами солі і тим вищий ступіньгідролізу β.
З підвищенням температуриендотермічний процес дисоціації води посилюється, рівновага зміщується в бік утворення йонів H+ і OH−. Збільшення концентрації йонів, що утворюються внаслідок дисоціації води, посилює процеси зв'язування їх з катіонами або аніонами солі, і ступінь гідролізу β зростає.
Якщо в розчині солі, що зазнала гідролізу, підвищити концентрацію одного з продуктів реакції,то рівновага гідролізу, за принципом Ле Шательє, зміститься в бік вихідної солі і ступінь гідролізу зменшиться. Наприклад, якщо до розчину натрій ацетату додати натрій гідроксид, концентрація йону OH− збільшиться; рівновага гідролізу цієї солі (див. наведене вище рівняння гідролізу) зміститься таким чином, щоб послабити збільшення концентрації цих йонів, тобто в бік вихідних речовин, і ступінь гідролізу зменшиться.
Від розбавленняводою кількість частинок розчиненої речовини в одиниці об'єму зменшується і рівновага гідролізу зміщується в такому напрямі, щоб послабити зменшення кількості частинок розчиненої речовини. Якщо під час гідролізу з однієї молекули розчиненої солі утворюються два продукти гідролізу (див. йонні рівняння гідролізу натрій ацетату, натрій карбонату, цинк хлориду), то рівновага таких реакцій зсувається в бік утворення продуктів (більшого числа частинок) і ступінь гідролізу зростає. При перебігу гідролізу солі слабкої основи і слабкої кислоти число частинок розчиненої речовини у розчині не змінюється (див. рівняння гідролізу амоній ацетату), тому рівновага гідролізу від розбавлення не зміщується.