 |
|
Електричний струм у розчинах і розплавах електролітів
Завдання 1. Підготувати і продемонструвати електропровідність дистильованої води і водних розчинів деяких речовин.
Обладнання: два саморобних спеціальних електроди, амперметр із шунтом на 3 А, електрична лампа на 15—25 Вт у стінному патроні, хімічні стакани: на 200—250 мл — 4 шт., на 100 мл — 3 шт., кухонна сіль, цукор-пісок, концентрована сірчана кислота, дистильована вода в окремій посудині—1000 мл, штатив з коротким стояком, дві муфти, два кільця до штатива, провідник на ізоляційній ручці, скляна паличка, спиртівка, азбестова сітка, з'еднувальні проводи, ящик-підставка.
Література: 1. Миргородський Б.Ю., Шабаль В.К. Демонстраційний експеримент з фізики. Електродинаміка, дослід 30, с. 54-55.
2. Демонстрационный эксперимент по физике в средней школе. Ч.1./под ред. А.А.Покровского, опыт 132.
| Мал. 1. Схема будови електрода-щупа. |
 Для виконання цього досліду треба ви-готовити з алюмініевого дроту товщиною 5...6 мм два електроди-щупи (мал 1). Нижні кінці електродів злегка загострюють, а верхні згинають. До верхніх кінців приєднують гнучкі проводи, за допомогою яких щупи вмикають у коло. Ці кінці старанно ізолюють, натягнувши на них гумову трубку або обмотавши пластикового ізоляційною стрічкою.
Для виконання цього досліду треба ви-готовити з алюмініевого дроту товщиною 5...6 мм два електроди-щупи (мал 1). Нижні кінці електродів злегка загострюють, а верхні згинають. До верхніх кінців приєднують гнучкі проводи, за допомогою яких щупи вмикають у коло. Ці кінці старанно ізолюють, натягнувши на них гумову трубку або обмотавши пластикового ізоляційною стрічкою.
Дослід краще виконувати при напрузі 36 В, що гарантуе безпеку.
Перед тим як виконувати дослід, у хімічні стакани на 250 мл наливають на 3/4 дистильованої води, а в стакани на 100 мл насипають до половини сухої дрібної кухонної солі й цукру-піску. У третій стакан наливають концентрованої сірчаної кислоти. На стакани слід наклеїти етикетки з написами.
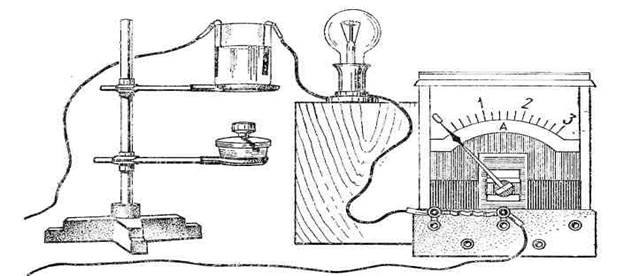
Мал. 2. Установка для демонстрування електропровідності дистильованої води й водних розчинів деяких речовин і залежності опору електролітів від температури.
Установку для досліду складають, як показано на мал. 2. У коло лампи послідовно вмикають амперметр і за допомогою електродів-щупів — досліджуваний зразок речовини.
Спочатку послідовно демонструють відсутність струму в колі, коли електроди занурені в дистильовану воду, концентровану сірчану кислоту, сіль і цукор. Перед кожним зануренням електродів за допомогою ізольованого провідника з оголеними кінцями або провідником на ізоляційній ручці корисно замкнута коло, демонструючи наявність напруги.
Із цієї частини досліду роблять висновок, що всі ці речовини є діелектриками, ізоляторами.
Потім у стакан з дистильованою водою занурюють щупи й потроху сиплять у воду кухонну сіль, розмішуючи розчин скляною паличкою. Зі збільшенням концентрації солі розжарення лампи зростає, а амперметр показуе збільшення сили струму. Дослід закінчують як тільки лампа засвітиться повністю.
У другий великий стакан з водою добавляють сірчану кислоту, демонструють добру електропровідність водного розчину кислоти. Кислоту у воду слід добавляти краплями, занурюючи скляну паличку спочатку в кислоту, а потім у воду. Розчин потрібно розмішувати паличкою.
Нарешті, в третій стакан з водою насипають цукор (можна відразу сипати багато цукру), й зануривши електроди в розчин, переконуються, що водний розчин цукру не є електролітом.
Цю серію дослідів бажано закінчити перевіркою електропровідності води, взятої з водопроводу. Звичайно, водопровідна вода проводить електричний струм — лампа установки ледве світиться. Ця частина досліду потрібна для того, щоб у учнів не склалося враження, що всяка вода діелектрик. Діелектриком є лише дистильована вода.
Завдання 2. Підготувати і продемонструвати рух іонів в електричному полі.
Обладнання:пластинка листового скла (150х200 мм), два латунні або жерстяні електроди з припаяними до них провідниками, джерело постійного струму (ВУП-1, ВУП-2), кусочок темної штопальної нитки, реактиви, основа універсального штатива, лапка, фільтрувальний папір.
Література: 1. Миргородський Б.Ю., Шабаль В.К. Демонстраційний експеримент з фізики. Електродинаміка, дослід 32.
2. Демонстрационный эксперимент по физике в средней школе. Ч.1./под ред. А.А.Покровского, опыт 133.
Рух іонів в електричному полі виявляють за допомогою індикатора — розчину, який змінюе своє забарвлення. Для іонів гідроксилу індикатором є фенолфталеїн, для іонів водню — метилоранж.
Дослід виконують так. Кусочок скла покривають товстим фільт-рувальним папером, змоченим розчином кухонної або глауберової солі з добавкою кількох крапель індикатора. Папір повинен бути вологим, але не настільки, щоб розчин стікав з нього. По краях паперу накладають електроди—дві латунні або жерстяні смужки довжиною 100...120 мм, завширшки 15...20 мм. Проводи від електродів приєднують до джерела постійного струму з напругою до 250 В. Чим вища напруга, тим швидше рухаються іони і, отже, дослід вимагае менше часу. Електроди на папері закріплюють двома прищіпками для білизни.
Посередині між електродами на папір накладають темну штопальну нитку, змочену розчином їдкого калію або їдкого натрію, коли хочуть показати рух іонів гідроксилу, або розчином соляної кислоти, коли потрібно показати рух іонів водню.
На електроди подають напругу і через деякий час починае по-ширюватися забарвлення паперу в напрямі до одного з електродів. Іони гідроксилу рухаються до анода і забарвлюють папір у малиновий колір, іони водню рухаються до катода і забарвлюють папір у рожевий колір. Одночасно спостерігаеться забарвлення паперу і в інший бік, що є наслідком дифузії, але це забарвлення не поширюеться далеко від нитки. Щоб поширення забарвления було помітним, потрібно 5...8 хв. Пластинку бажано підсвітити знизу або збоку.

|
| Мал. 3. Установка для демонстрування руху іонів. |
Недоліком цього досліду є те, що він демонструє рух іонів одного знака. Щоб показати рух іонів різних знаків одночасно, роблять так. Великий кусок фільтрувального паперу змочують розчином кухонної солі, а під електроди підкладають вузенькі смужки такого самого паперу, змочені розчином мідного купоросу (під анод) і двохромокислого калію (під катод). Якщо тепер увімкнути напругу, то майже відразу видно переміщення жовтої смуги від катода до анода і синюватої — від анода до катода. Ширина цих смуг різна, що свідчить про різну швидкість іонів різних знаків.
Установку для демонстрування руху іонів в електричному полі зображено на мал. 3.
Завдання 3. Підготувати і продемонструвати залежність опору електролітів від температури.
Обладнання: хімічний стакан на 200—250 мл, електрична лампа 15— 25 Вт, амперметр із шунтом на 1 А, дистильована вода, кухонна сіль, спиртівка, сірники, штатив з коротким стояком, дві муфти, два кільця до штатива, провідник на ізоляційній ручці, з'єднувальні проводи, електроди із жерсті або алюмінієвого дроту, ящик-підставка.
Література: 1. Миргородський Б.Ю., Шабаль В.К. Демонстраційний експеримент з фізики. Електродинаміка, дослід 33.
2. Демонстрационный эксперимент по физике в средней школе. Ч.1./под ред. А.А.Покровского, опыт 134.
Установку для виконання досліду складають, як показано на мал. 2. У хімічний стакан наливають на 2/3 його висоти дистильованої води і занурюють два жерстяних електроди (можна використати електроди-щупи, описані у завданні 1). У коло такого вольтаметра, послідовно вмикають електричну лампу на 15—25 Вт і амперметр. Цю установку вмикають у мережу з напругою 36, 127 або 220 В. Оскільки в стакані дистильована вода, то електричне коло розірване. Замикаючи електроди провідником на ізоляційній ручці, демонструють, що до води прикладена напруга.
У воду потроху насипають кухонної солі, розмішують розчин скляною паличкою, поки лампа не почне слабо світитись (амперметр покаже невелику силу струму). При незмінній напрузі сила струму залежить від опору електроліта.
Запалюють спиртівку і поволі підігрівають електроліт. При цьому спостерігають зростання сил и струму в колі, що відмічають за допомогою амперметра і лампи, яка світиться інтенсивніше. Якщо забрати нагрівник і дати лектроліту в стакані остигнути, можна помітити, що лампа світиться слабше в міру остигання електроліту і що амперметр показуе зменшення сили струму. Щоб прискорити остигання електроліту, стакан обгортають вологою тканиною або ставлять на сніг, при цьому слід періодично перемішувати електроліт скляною паличкою.
3 досліду роблять висновок про те, що опір електролітів зі зростанням температури зменшується, а опір металевих провідників зростає. Це пояснюють тим, що при нагріванні процес дисоціації інтенсифікується — внаслідок зменшення в'язкості розчинника (води) збільшується рухливість іонів.
Завдання 4. Підготувати і продемонструвати електроліз розчину мідного купоросу.
Обладнання:набір Горячкіна для електролізу, міцний розчин мідного купоросу, джерело постійного струму, вимикач, з'єднувальні проводи, ящик-підставка.
Література: 1. Миргородський Б.Ю., Шабаль В.К. Демонстраційний експеримент з фізики. Електродинаміка, дослід 35.
2. Демонстрационный эксперимент по физике в средней школе. Ч.1./под ред. А.А.Покровского, опыт 137.
У стакан від набору Горячкіна наливають на 2/з його висоти міцний розчин мідного купоросу, який слід приготувати заздалегідь, щоб він відстоявся і був прозорим. У розчин занурюють два вугільнї електроди, закріплені в клемах кришки з набору. Вуглини електродів треба старанно очистити за допомогою дрібного наждачного паперу й промити.
Електроди протягом 40...60 с витримують в електроліті, не вмикаючи струму, а потім виймають і демонструють відсутність будь-яких змін на їх поверхні. Потім електроди вмикають у коло будь-якого джерела постійного струму, яке забезпечуе напругу 2...4 В і через 1... 1,5 хв, вмикнувши струм, виймають. Показують, що на одному з електродів, а саме на катоді, осів тонкий шар міді. Знову занурюють електроди в електроліт і через 2...3 хв виймають, звертаючи увагу учнів на те, що кількість міді значно збільшилась. Уже із цього можна зробити висновок про те, що кількість речовини, яка виділяється на катоді, залежить від часу проходження струму через електроліт.
Досшід продовжують, змінивши полярність електродів на обернену і переконуються, що мідь, яка раніш осіла на катоді, переходить у розчин, тобто анод розчиняється. Цей висновок буде використано далі в процесі вивчення застосування електролізу в техніці (анодне розчинення). Потім доцільно, замінивши електрод, покритий міддю, увімкнути вольтаметр у коло змінного струму з тією самою напругою. Через деякий час (2...4 хв) переконуються, що електроди залишаються чистими. Іноді це пояснюють тим, що змінний струм зовсім не спричиняе виділення речовини. Але це не правильно. Справа в тому, що полярність електродів двічі протягом одного періоду змінюеться на обернену, і скільки речовини виділиться на електроді протягом половини періоду, стільки ж її буде розчинено протягом другої половини періоду.
| Мал. 4. Електроліз мідного купоросу. |
 Дослід продовжують, увімкнувши в коло вольтаметра амперметр. Установивши в колі вольтаметра деяке мале значения сили струму, протягом певного часу пропускають струм, фіксують на око інтенсивність покриття катода міддю. Замінюють катод свіжою вуглиною, а коли такої можливості немае, катод і анод міняють місцями і, встановивши вдвічі більший струм, пропускають його протягом того самого інтервалу часу. Виймають електроди і демонструють збільшення кількості міді, яка виділилася на катоді. Цього цілком достатньо, щоб зробити висновок: кількість речовини, яка виділяеться на катоді, залежить від сили струму. Об'еднавши обидва висновки і ввівши коефіціент пропорційності між масою виділеної речовини та кількістю електрики, що пройшла через вольтаметр, формулюють перший закон Фарадея. Під час теоретичного виведення першого закону Фарадея з'ясовують глибше фізичний зміст електрохімічного еквівалента речовини і спосіб його визначення.
Дослід продовжують, увімкнувши в коло вольтаметра амперметр. Установивши в колі вольтаметра деяке мале значения сили струму, протягом певного часу пропускають струм, фіксують на око інтенсивність покриття катода міддю. Замінюють катод свіжою вуглиною, а коли такої можливості немае, катод і анод міняють місцями і, встановивши вдвічі більший струм, пропускають його протягом того самого інтервалу часу. Виймають електроди і демонструють збільшення кількості міді, яка виділилася на катоді. Цього цілком достатньо, щоб зробити висновок: кількість речовини, яка виділяеться на катоді, залежить від сили струму. Об'еднавши обидва висновки і ввівши коефіціент пропорційності між масою виділеної речовини та кількістю електрики, що пройшла через вольтаметр, формулюють перший закон Фарадея. Під час теоретичного виведення першого закону Фарадея з'ясовують глибше фізичний зміст електрохімічного еквівалента речовини і спосіб його визначення.
Установку для електролізу мідного купоросу зображено на мал. 60. Якщо джерелом струму в цьому досліді є випрямляч з регульованою постійною напругою (ВС-24 м), струм у колі вольтаметра змінюють, обертаючи ручку трансформатора випрямляча. В інших внпадках у коло вмикають реостат на кілька омів.
Завдання 5. Підготувати і продемонструвати електроліз підкисленої води.
А) Обладнання:газовий вольтаметр (вольтаметр Гофмана), 10...15 %-ний водний розчин сірчаної кислоти, джерело постійного струму, амперметр із шунтом на 3 А, дві пробірки, тоненькі соснові скалочки, вимикач, сірники.
Література: 1. Миргородський Б.Ю., Шабаль В.К. Демонстраційний експеримент з фізики. Електродинаміка, дослід 36.
2. Демонстрационный эксперимент по физике в средней школе. Ч.1./под ред. А.А.Покровского, опыт 136.
Газовий вольтаметр або вольтаметр Гофмана (мал. 5) складаєеться з трьох скляних трубок, з'еднаних у нижній частині. Дві з них призначені для збирання газів, що виділяються під час елекролізу і мають на верхніх кінцях крани. У нижній частині цих трубок впаяні електроди, до виводів яких підводять електричний струм. Є конструкції вольтаметрів з вугільними, платиновими або платиновим і срібним електродами. Третя, середня, трубка вольтаметра має на верхньому кінці лійку, через яку вольтаметр заповнюють електролітом (крани двох інших трубок відкриті). Як тільки рівень електроліту наближається до кранів, їх закривають, а електроліт продовжують наливати доти, поки лійка тонкої трубки не буде заповнена на 1/3 її об'єму. Повітря, яке може залишитись у просторі під кранами, обережно випускають, повертаючи пробку крана. Працюючи з вольтаметром, треба пам'ятати, що в нього налито звичайно агресивну рідину (розчин кислоти або лугу).
Слід зазначити, що дослід з вольтаметром Гофмана, коли продукти електролізу виділяються у вигляді газу, дає змогу точніше визначити їхню масу. Справді: тиск, під яким перебувають гази у вольтаметрі, можна вважати сталим і таким, що практично дорівнює атмосферному, температура їхня стала і, отже, маса газу пропорційна його об'ему. А об'ем газу в трубці вольтаметра можна визначити з точністю до десятих частин кубічного сантиметра.
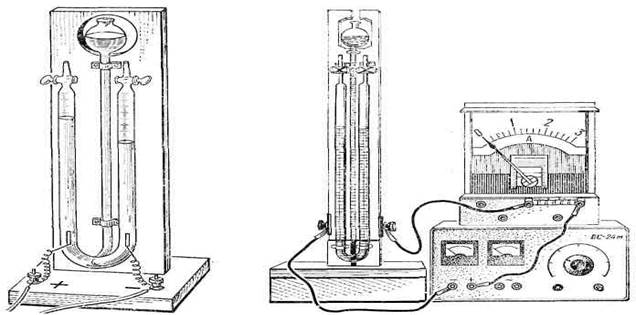
|
| Мал. 5. Газовий вольтаметр (вольтаметр Гофмана). |
| Мал. 6. Дослід з вольтаметром Гофмана. |
Дослід з вольтаметром Гофмана (мал. 6) виконують в такій послідовності. Заповнивши вольтаметр електролітом, складають електричне коло з джерела струму на 4...8 В, амперметра і вольтаметра ввімкнутого послідовно. У разі потреби в коло вмикають ключ і реостат на кілька омів. Якщо користуються випрямлячем ВС-24м, реостат і ключ не потрібні. Установлюють силу струму 0,2...0,4 А і на короткий час (20...40 с) вмикають вольтаметр. Це потрібно робити для того, щоб електроліт був насичений газами. Справа в тому, що водень і кисень мають різну розчинність у воді, внаслідок чого співвідношення об'ємів них газів може бути не точним. Через 1...2 хв випускають гази з трубок приладу, який тепер готозий до демонстрування.
Після цього вмикають струм і одночасно вимірюють час за го-динником або пускають демонстраційний секундомір. Коли на катоді, де виділяється водень, збереться приблизно 1/2 об'єму трубки водню, струм вимикають. Слід звернути увагу учнів на те, що об'єм кисню, який виділився в трубці з анодом, вдвічі менший, ніж водню.
Дослідження газів проводять так. Кран трубки, яка містить кисень, поволі відкривають і в струмінь газу вносять тліючу скалочку, яка відразу яскраво спалахує. На кінець трубки можна надіти тонку гумову трубку й випустити кисень у пробірку, тримаючи її відкритим кінцем угору, а потім у пробірку внести тліючу скалочку. Для дослідження водню на кінець трубки вольтаметра насаджують перекинуту догори дном пробірку, яку тримають у руці. Відкривають кран трубки і випускають водень у пробірку. Знизу до отвору пробірки підносять запалену скалочку: водень з легким вибухом згоряе. Можна, надівши на трубку з воднем гумову трубку, випустити його в мильний розчин, налитий у широку посудину. Коли водень витікае в мильний розчин, утворюються бульбашки, наповнені сумішшю водню і повітря — гримучим газом. Якщо до бульбашок піднести палаючу скалочку, станеться легкий вибух, про який слід попередити учнів.
Випускають гази з трубок вольтаметра і повторюють дослід, змінивши силу струму в 2 — 3 рази. Струм пропускають протягом того самого часу, що й у першому досліді. Констатують, що об'єми газів, виділених при цьому, змінилися в таку саму кількість разів. Із цього роблять висновок, що маса газів пропорційна кількості електрики, що пройшла через вольтаметр. Порівнюючи об'єм кисню і водню в обох дослідах, переконуються, що їх маси відносяться як 1:8, тобто пропорційні їхнім хімічним еквівалентам.
Б) Обладнання: саморобний вольтаметр, рідинний демонстраційний манометр з відрізком гумової трубки, джерело постійного струму, з'еднувальні проводи, ящик-підставка, електроліт.
Для виконання цього досліду, який можна вважати демонструванням першого закону Фарадея, виготовляють вольтаметр з графітовими електродами. Отвір скляної товстостінної банки щільно закривають гумовою пробкою, крізь яку пропущені виводи від двох графітових електродів і скляна трубка (бажано з краном). Можна використати двогорлу, як показано на мал 7, або тригорлу банку. Електродами правлять графітово-вугільні стержні від гальванічного елемента, до металевих ковпачків яких припаяні провідники. Банку заповнюють 10...15 %-ним розчином їдкого натрію або їдкого калію на ¾ висоти. Трубку, яка виходить з банки, з'єднують з одним з колін де-монстраційного манометра. Перед цим потрібно «продути» вольтаметр: увімкнути на 20...30 с струм при відкритому крані трубки.

|
| Мал. 7. Установка для демонстрування закону Фарадея з саморобним вольтаметром. |
Потім вмикають струм 0,1...0,2 А і пропускають його стільки часу, скільки потрібно для того, щоб різниця рівнів рідини в манометрі становила 10 поділок його шкали. Випускають газ з коліна манометра і повторюють дослід протягом того самого інтервалу, але збільшивши силу струму в два рази. Тепер різниця рівнів становить 20 поділок. Оскільки можна вважати, що тиск газу в коліні манометра сталий і дорівнює атмосферному, і температура його також залишаеться сталою, масу газу вважаємо пропорційною його об'єму. Отже, кількість речовини, виділеиої під час електролізу, пропорційна кількості електрики, яка пройшла через електроліт.
Завдання 6. Підготувати і виконати фронтальну лабораторну роботу "Дослідження явища електролізу".
Література: 1. Підручник з фізики для 9 класу.
Завдання 7. Перегляньте навчальний кінофільм "Електроліз і його застосування в техніці" та складіть до нього запитання і анотацію.
Завдання 8. Розглянути деякі ППЗ з теми. Вкажіть, які із комп’ютерних експериментів і відеозаписів можна використати при вивченні цієї теми. Складіть відповідні методичні рекомендації.