 |
|
Коагуляція колоїдних розчинів
Стійкість дисперсної системи – це сталість її стану та основних властивостей: дисперсності, рівномірного розподілу частинок дисперсної фази в об’ємі дисперсійного середовища та характеру взаємодії між частинками.
| |||||||||||||
 |  | ||||||||||||
|
| ||||||||||||
|
| ||||||||||||
Коагуляція – це процес злипання колоїдних частинок з утворенням більш крупних агрегатів та втратою агрегативної стійкості.
Механізм коагуляції

Схема взаємодії колоїдних частинок:
а – коагуляція; б – агрегативно стійка система.
Етапи коагуляції:
1. Зближення частинок на відстань, при якій енергія їх взаємного молекулярного притяжіння більше енергії теплового (броунівського) руху;
2. Якщо енергія взаємного притяжіння більше, ніж електростатичне відштовхування відбудеться коагуляція.
Фактори, що впливають на коагуляцію:
· додавання електролітів (впливають на товщину подвійного електричного шару та на  -потенціал);
-потенціал);
· нагрівання або заморожування;
· механічні дії (інтенсивне струшування, перемішування).
Правила коагуляції
(влив електролітів на коагуляцію):
1. Коагуляцію викликають не всі іони електроліту, а тільки ті, які мають заряд протилежний знаку заряду колоїдної частинки;
2. Здатність викликати коагуляції тим сильніше, чим вище заряд електроліта (ця закономірність називається правилом значності або правилом Шульце – Гарді).
3. В ряду іонів з однаковим зарядом їх коагулююча активність зростає зі зменшенням гідратації. Іони лужних металів за їх коагулюючою здатністю розташовуються в ряд (ліотропні ряди):

Аніони теж утворюють аналогічні ряди, але різниця в їх коагулюючій здатності незначна:

4. Електроліти викликають коагуляцію при досягненні ними певної концентрації.
Поріг коагуляції  – це мінімальна молярна концентрація еквіваленту електроліту, яка викликає коагуляцію.
– це мінімальна молярна концентрація еквіваленту електроліту, яка викликає коагуляцію.
Поріг коагуляції розраховують за формулою:
 де
де  – поріг коагуляції моль/л (іноді в (ммоль/л));
– поріг коагуляції моль/л (іноді в (ммоль/л));
 – молярна концентрація еквівалента електроліту,
– молярна концентрація еквівалента електроліту,
моль/л;
 – об’єм золю, л;
– об’єм золю, л;
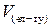 – об’єм доданого електроліту, л.
– об’єм доданого електроліту, л.
5. В ряду органічних іонів коагулююча дія зростає з підвищенням адсорбційної здатності.
Ліофобні колоїди характеризуються нестійкістю та здатністю до зменшення дисперсності з часом. Самодовільний процес укрупнення частинок в ліофобних золях називається старіннямабо автокоагуляцією. Причиною старіння є повільний процес перекристалізації ядра міцели та змінення дзета-потенціалу.
Колоїдний захист

 Колоїдний захист – це механізми, що перешкоджають коагуляції колоїдних частинок. Основну захисну функцію виконує оболонка з гідратованих протиіонів дифузного шару навколо колоїдної частинки, яка захищає її від злипання. Чим товщий дифузний шар, тим стабільніший відповідний гідрозоль.
Колоїдний захист – це механізми, що перешкоджають коагуляції колоїдних частинок. Основну захисну функцію виконує оболонка з гідратованих протиіонів дифузного шару навколо колоїдної частинки, яка захищає її від злипання. Чим товщий дифузний шар, тим стабільніший відповідний гідрозоль.
Захисне число (кількісне вираження здатності захищати золі від коагуляції) – це кількість мг сухої ВМС, що захищає 10 мл золю від коагуляції при приливанні до нього 1 мл 10% розчину  (чим більше З.Ч., тим слабкіша захисна дія даної ВМС.
(чим більше З.Ч., тим слабкіша захисна дія даної ВМС.
Наприклад:
P желатина, казеїн (захисні числа 0,01 – 0,1) – значна захисна дія;
P крохмаль, декстрини (захисні числа 20 – 45) – слабка захисна дія. Механізм захисної дії ВМС можна пояснити тим, що макромолекули адсорбуються на поверхні колоїдних частинок, створюючи адсорбційні сольватні шари, які підвищують гідрофільність колоїдних частинок.