|
|
Експериментальна частина
1.Приготування розчину із заданою масовою часткою з наважки солі.
Прилади і реактиви: мірна колба на 50 мл , ареометр . Наважка солі.
Мета роботи: навчитися готувати розчин із заданою концентрацією з наважки солі. Оволодіти методикою денсиметрії.
завдання
1) приготувати розчин з наважки солі ;
2 ) виміряти густину приготованого розчину.
3) обчислити молярну , нормальну , моляльну концентрації отриманого розчину, а також його титр і мольну частку солі в розчині.
Вимоги техніки безпеки
При виконанні лабораторної роботи необхідно дотримуватися загальних правил техніки безпеки для хімічних лабораторій. З розчинами кислот і лугів поводитися обережно, при потраплянні їх на руки або одяг слід змити відразу ж великою кількістю води. Осколки скла прибирати або щіткою, або ганчірочкою або серветкою.
Порядок виконання експерименту
1. Отримати у викладача завдання на виконання досліду.
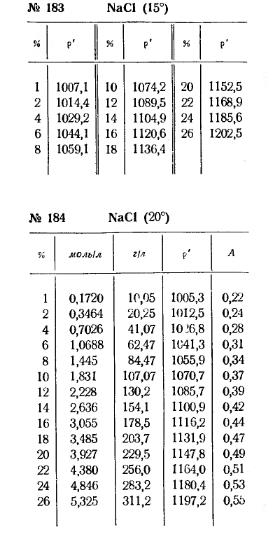
2. Розрахувати, скільки солі та води потрібно для приготування розчину заданої концентрації загальним об'ємом 50 мл. Використовувати значення густини знайдене по таблиці 1, ρтеорет.
3. Необхідну кількість солі перенести в мірну колбу. Невеликими порціями вливати воду в колбу при постійному перемішуванні. Після розчинення солі довести розчин до мітки.
4. Отриманий розчин перелити в циліндр (на 50 мл) і ареометром виміряти його густину. Якщо показання ареометра не збігаються з табличними даними, то масову частку визначити методом інтерполяції. Метод інтерполяції полягає у визначенні проміжного, між табличними, значення шуканої величини.
Припустимо, що за допомогою ареометра визначено густину розчину хлориду натрію 1,081. За методом інтерполяції розрахунок проводять у наступному порядку.
1) По таблиці густин знаходять менше і більше значення масової частки NaCl і густини розчинів:
менше значення ω = 10%, менше значення густини = 1,0742 г / мл;
більшого значення ω = 12%, більше значення густини = 1,0895 г / мл.
2) Знаходять різницю між табличними значеннями густин і концентрацій:
1,0895 - 1,0742 = 0,0153 (г / мл),
10 - 12 = 2 (%).
3) Знаходять різниця між значенням густини, визначеної ареометром, і меншим табличним: 1,081-1,0742 = 0,0068 (г / мл).
4) Складають пропорцію і вирішують її:
2 (%) - 0,0153 (г / мл)
х - 0,0068 (г / мл)
х = 2 · 0,0068 / 0,0153 = 0,89 %
5) Знайдене число додають до меншого табличного значення масової частки і отримують масову частку NaCl в розчині з густиною 1, 081:
10 + 0,89 = 10,89 %.
Оформлення досліду в робочому зошиті
1) Назва досліду
2 ) Вихідні дані
3) Розрахунок маси солі
4 ) Значення густини приготованого розчину , ρ практ .
5 ) Розрахунок похибки експерименту .
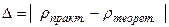 (абсолютна похибка)
(абсолютна похибка)
 ( відносна похибка )
( відносна похибка )
3) Використовуючи величину густини розчину і відсоткову концентрацію(%), обчислити молярну, нормальну, моляльну концентрації отриманого розчину, а також його титр і мольну частку солі в розчині. Повинні бути приведені повні розрахунки: з назвами концентрацій, формулами для розрахунку концентрацій, значеннями, що використовуються для розрахунку величин та зазначенням одиниць виміру (розмірності) . Отримані результати подати у вигляді таблиці 2 .
Таблиця 2
| Розчин | Концентрації | |||||||
| Маса солі, г | Маса води,г | ρтеорет., г/мл | 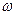 ,
% ,
%
| СМ, моль/л | N, моль/л | Т, г/мл | Сm, моль/кг | ω |
7 ) Висновок:
2. Приготування розчину хлороводневої кислоти заданної концентрації з концентрованого розчину кислоти (35%), визначення точної концентрації розчину титруванням.
Прилади і реактиви: лійка, мірний циліндр, мірна колба на 50 мл, піпетка на 10 мл, бюретка, 3 конічні колби, розчин фенолфталеїну, 0,1 н розчин NaOH.
Мета роботи: навчитися готувати розчин із заданою концентрацією методом розведення. Оволодіти методом визначення концентрації титрування.
Вимоги техніки безпеки
Під час роботи з мінеральними кислотами слід дотримуватись правил техніки безпеки: використовувати гумові рукавички і захисні окуляри, доливати відміряну циліндром кислоту у воду тоненьким струменем при постійному помішуванні. Якщо додавати воду до кислоти, то сильний розігрів суміші може викликати розбризкування кислоти і призвести до опіків. При сильному розігріванні суміші процес переривають для охолодження. Кислоту, що потрапила на підлогу і столи, засипають піском, нейтралізують натрію або кальцію карбонатом. Кислоту на одязі змивають великою кількістю води, нейтралізуючи розчином амоніаку або натрію гідрокарбонату.
Розчиняючи у воді луги (калію і натрію гідроксиди), користуються захисними окулярами і гумовими рукавичками. Ці речовини викликають хімічні опіки, тому брати їх руками заборонено!
Завдання
1) Приготувати розчинхлороводневої кислоти заданої концентрації з концентрованого розчину кислоти (35%).
2) Визначити методом титрування точної концентрацію приготованого розчину.
Порядок виконання експерименту
1. Отримати у викладача завдання на виконання досліду.
2. Обчислити об’єм концентрованого розчину кислоти, необхідний для приготування 50 мл заданого розчину.
3. Мірним циліндром або мірною бюреткою відміряти необхідний об’єм конц. розчину HCl . Налити в мірну колбу близько половини необхідної води. Вилити кислоту у мірну колбу з водою. Двічі обполоснути циліндр дистильованою водою, злити воду в ту ж колбу.
4. Вміст колби долити до мітки водою. Коли рівень рідини буде нижче мітки на 0,5-1 см , додавати воду слід по краплях з крапельниці. Розбавлення можна вважати закінченим, коли нижній рівень меніска рідини торкнеться мітки на колбі.
5. Закрити колбу пробкою і перемішати розчин, багаторазово перевертаючи колбу. Приготований розчин використовувати для титрування.
6. У мірну бюретку, закріплену в штативі, налити розчин лугу з еквівалентною концентрацією 0,1 моль / л ( 0,1 н . ). Цей розчин називається робочим розчином.
7. У три конічні колби набрати за допомогою мірної піпетки по 10 мл розчину HCl, приготованому раніше, додати в кожну колбу по одній краплі індикатора фенолфталеїну.
8. З бюретки повільно (по краплях) додавати розчин лугу до розчину кислоти до зміни забарвлення індикатора. По закінченні титрування записати об’єм лугу, що пішов на титрування.
9. Дослід повторити ще два рази, кожного разу заздалегідь доливаючи розчин лугу в бюретку до нульової поділки.
10. Розрахувати середній об’єм лугу, що пішов на титрування, і еквівалентну концентрацію кислоти. Обчислити титр розчину.
11. Зіставити концентрацію приготованого розчину, знайдену методом титрування, із заданим значенням. Розрахувати похибку, допущену при приготуванні розчину, у висновку вказати причини похибки.
Оформлення досліду в робочому зошиті
1) Назва досліду
2 ) Вихідні дані
3) Розрахунок об’єму конц. кислоти
4 ) Результати титрування та розрахунок концентрації HCl.
5 ) Розрахунок похибки експерименту .
D=Nпракт- Nтеорет(абсолютна похибка)
δ = D · 100%/ Nтеорет ( відносна похибка )