 |
|
Термодинамические процессы
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
ГОУ ВПО ЧЕРЕПОВЕЦКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Факультет общематематических и естественнонаучных дисциплин
 |
Кафедра химии
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
К ПРАКТИЧЕСКИМ ЗАНЯТИЯМ
ПО КУРСУ «ФИЗИЧЕСКАЯ ХИМИЯ»
РАЗДЕЛ «ТЕРМОДИНАМИКА
И ХИМИЧЕСКОЕ РАВНОВЕСИЕ»
Учебно-методическое пособие
Череповец
Методические указания к практическим занятиям по курсу «Физическая химия». Раздел «Термодинамика и химическое равновесие»: Учеб.-метод. пособие. – Череповец: ГОУ ВПО ЧГУ, 2005. – 40 с.
Рассмотрено на заседании кафедры химии, протокол № 4 от 22.12.03 г.
Одобрено редакционно-издательской комиссией Института металлургии и химии ГОУ ВПО ЧГУ, протокол № 1 от 29.01.04 г.
Составитель: Г.А. Котенко – канд. хим. наук, доцент
Рецензенты: Е.А. Шестакова – канд. техн. наук, доцент (ГОУ ВПО ЧГУ); С.А. Щелкунов – канд. хим. наук (ГОУ ВПО ЧГУ)
Научный редактор: Е.А. Шестакова – канд. техн. наук, доцент
© Котенко Г.А., 2005
© ГОУ ВПО Череповецкий государст-
 венный университет, 2005
венный университет, 2005
Введение
Цель настоящего учебно-методического пособия - научить студентов выполнению расчетных задач по химической термодинамике и химическому равновесию.
Пособие содержит три раздела, которые включают в себя подразделы. В начале каждого подраздела приведены краткие теоретические положения и основные формулы, необходимые для решения задач, а также примеры типичных задач.
Объем и содержание материала соответствует Государственному образовательному стандарту по специальности 240301 «Химическая технология неорганических веществ».
ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ
Термодинамические процессы
Математическое выражение первого закона термодинамики для процессов, связанных с бесконечно малыми изменениями состояния системы, имеет вид
 , (1)
, (1)
где q – теплота, т. е. неупорядоченная форма передачи энергии при хаотическом движении молекул; А – работа, т. е. форма передачи энергии при направленном движении системы (работа расширения: А = Р ∆V); U – внутренняя энергия, т. е. полный запас энергии при изохорическом процессе.
При изобарическом процессе полный запас энергии характеризуется энтальпией Н. Внутренняя энергия и энтальпия являются функциями состояния, свойствами системы. Соотношение между ними
Н = U + PV .
Теплота и работа не являются функциями состояния, они характеризуют систему во время процесса, служат формами передачи энергии.
Для конечного изменения состояния системы первый закон термодинамики запишется так:
∆U = q – A. (2)
Теплота q считается положительной, если она подводится к системе (поглощается), и отрицательной, если она отводится от системы (выделяется). Работа А считается положительной, если система совершает работу относительно окружающей среды, и отрицательной, если работа совершается над системой. ∆U считается положительной, если в ходе процесса внутренняя энергия возрастает.
Уравнения (1) и (2) справедливы для любой термодинамической системы в любом агрегатном состоянии. Для идеального газа выражения первого закона термодинамики, формулы вычисления теплоты и работы в четырех основных термодинамических процессах приведены в таблице:
| Процесс | Первый закон термодинамики | Работа | Теплота | Уравнение состояния газа |
| Изобари- ческий | 
| P(V2 – V1) R(T2 – T1) | Cp(T2 – T1) | 
|
| Изохори- ческий | 
| Cv(T2 – T1) | 
| |
| Изотерми- ческий | qТ = AT | 
| 
| P V = const |
Адиабати- ческий

| ∆U = -A | Cv (T1 – T2)


| 


|
Взаимосвязь между атомной или мольной теплоемкостями идеального газа при постоянном давлении Ср и при постоянном объеме Сv следующая: Ср - Сv = R, где R – универсальная газовая постоянная, численно равная работе расширения, которую совершает 1 моль идеального газа при повышении его температуры на 1 градус, R = 8,314 Дж/(моль · К).
Мольная теплоемкость идеального газа при постоянном объеме при сравнительно невысоких температурах равна:
а) для одноатомных газов – (3/2)R;
б) для двухатомных газов и трехатомных с линейными молекулами – (5/2)R;
в) для газов с нелинейными трехатомными и многоатомными молекулами – 3R.
Пример 1
Двуокись углерода в количестве 100 г находится при 273 К и давлении 1,013 · 105 Н/м2. Определить q, A, ∆U и ∆Н:
A) при изотермическом расширении до объема 0,2 м3;
Б) при изобарическом расширении до объема 0,2 м3;
В) при изохорическом нагревании до давления 2,026 .105 н/м2
Г) при адиабатическом сжатии до 2,026 .105 н/м2;
Принять, что СО2 подчиняется законам идеальных газов, а истинная молярная теплоемкость при постоянном давлении Ср постоянна и равна 37,1 Дж/моль*К.
РЕШЕНИЕ:
А) для изотермического расширения: ∆UT = 0, ∆HT = 0/
Первый закон термодинамики: q = A.
q = A = 
число молей СО2 равно: 
Запишем уравнение состояния идеальных газов (Менделеева - Клапейрона) для состояния 1: P1V1 = nRT. Отсюда:

Тогда:
q = A = 2,27.8,314 .273ln  = 7070 Дж.
= 7070 Дж.
Б) для изобарического процесса:
qp = ∆Hp = nCp (T2 – T1) =

Работа расширения газа в изобарическом процессе:

Согласно 1 закону термодинамики:
∆U = q – A = 67,4-15,0 = 52,4 кДж.
В) для изохорического процесса: А=0, V1 = const

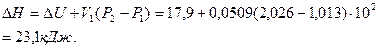
Г) для адиабатического процесса: q=0.
 ,
, 

