 |
|
Приготування розчинів
Приклад 1. Розрахувати процентну концентрацію розчину, отриманого при змішуванні 280 г води і 40 г цукру. Щоб вирахувати процентну концентрацію, необхідно знати масу речовини та масу розчину, в якому вона розчинена:

 г,
г, 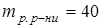 г.
г.
Відома кількість розчину і розчиненої речовини дають можливість скласти пропорцію:
40 г цукру міститься в 320 г розчину
 - - в 100 г розчину
- - в 100 г розчину
 %.
%.
Цю задачу можна розв’язати по-іншому, якщо застосувати друге визначення процентної концентрації: процентна концентрація показує, скільки процентів від маси всього розчину припадає на розчинену речовину. В цьому випадку масу розчину приймаємо за 100%, тоді процентний вміст речовини, розчиненої в розчині, розраховуємо так:
 %.
%.
Приклад 2. Скільки грамів сульфату натрію потрібно для приготування 5 л 8%-ного розчину, густина якого дорівнює 1,075 г/мл.
Для розв’язування задачі потрібно знати масу розчину, а також кількість розчиненої речовини. Можна визначити кількість розчиненої речовини, якщо відома процентна концентрація і маса розчину. Але в умові задачі кількість розчину подана в одиницях об’єму, а не в одиницях маси. Для визначення маси розчину використовуємо співвідношення  . При цьому необхідно дотримуватися однієї умови: об’єм і густина розчину повинні бути виражені в одній системі одиниць. Густина розчину подана в г/мл, тому об’єм розчину потрібно виражати також в мл:
. При цьому необхідно дотримуватися однієї умови: об’єм і густина розчину повинні бути виражені в одній системі одиниць. Густина розчину подана в г/мл, тому об’єм розчину потрібно виражати також в мл:
 мл,
мл,
звідки  г.
г.
Розчинена речовина складає 8% від маси всього розчину:
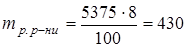 г.
г.
Отже, для приготування 5 л 8%-ного розчину потрібно взяти 430 г  .
.
Приклад 3. Яку кількість нітрату натрію треба взяти для приготування 300 мл 0,2 М розчину?
Розв’язування. Молярна концентрація означає, що в 1 л розчину знаходиться 0,2 моль  . Для того, щоб розрахувати масу
. Для того, щоб розрахувати масу  в грамах, потрібно спочатку обчислити молярну масу
в грамах, потрібно спочатку обчислити молярну масу  :
:
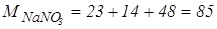 г/моль.
г/моль.
1 моль  містить 85 г.
містить 85 г.
0,2 моль  містить
містить 
 г.
г.
17 г  знаходяться в 1 л розчину. Кількість
знаходяться в 1 л розчину. Кількість  в даному об’ємі розчину (300 мл) знайдено за пропорцією
в даному об’ємі розчину (300 мл) знайдено за пропорцією
1000 мл вміщує 17 г 
300 мл - 
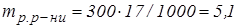 г.
г.
Для приготування 300 мл 0,2 М розчину  потрібно взяти 5,1 г
потрібно взяти 5,1 г  .
.
Приклад 4. До 500 мл 32%-ного розчину азотної кислоти, густина якого дорівнює 1,2 г/мл, додали 1 л води. Розрахувати процентну концентрацію одержаного розчину.
Маса одержаного розчину дорівнює сумі мас первинного розчину і води. Так як кількість первинного розчину і води подані об’ємними одиницями, то й ці величини потрібно виразити в одиницях маси.
Маса первинного розчину
 г.
г.
Маса води
 г.
г.
Маса одержаного розчину
 г.
г.
Маса розчиненої речовини складає 32% від маси первинного розчину:
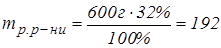 г.
г.
Знаходимо процентну концентрацію одержаного розчину:
192 г  міститься в 1600 г розчину
міститься в 1600 г розчину

 міститься в 100 г розчину
міститься в 100 г розчину
 %.
%.
Приклад 5. До якого об’єму потрібно розбавити 500 мл 20%-ного розчину хлориду натрію (густина 1,152 г/мл), щоб одержати 4,5%-ний розчин густиною 1,029 г/мл.
Розв’язування. Для того, щоб розв’язати цю задачу, потрібно знайти масу NaCl, що міститься в початковому розчині.
Обчислимо спочатку масу розчину:
 г.
г.
в 100 г розчину міститься 20 г NaCl;
в 576 г розчину міститься X г NaCl.
 г.
г.
Знаючи кількість розчиненої речовини (115,2 г NaCl) і Ср, одержаного розчину, можна вирахувати його масу:
4,5 г NaCl знаходяться в 100 г розчину;
115,2 г NaCl знаходяться в  .
.
 г.
г.
Об’єм одержуваного розчину знаходимо за співвідношенням
 мл.
мл.
Початковий розчин потрібно розбавити дистильованою водою до об’єму 2488 мл.
Приклад 6. Скільки мілілітрів 2 н. розчину сірчаної кислоти потрібно для приготування 500 мл 0,5 н. розчину?
Розв’язування. При розбавленні розчину кількість розчиненої речовини, вираженої в будь-яких одиницях (грамах, моль, еквівалентах), залишається постійною. В даному випадку мова йде про кількість еквівалентів, тобто даються нормальні концентрації первинного і одержаного розчинів. Кількість еквівалентів дорівнює добутку нормальної концентрації на об’єм розчину (в літрах):
 ;
;  .
.
Отже  .
.
Підставимо у це співвідношення всі задані умовами задачі величини:

 л.
л.