 |
|
Кислоти – це електроліти, які при дисоціації утворюють тільки один вид катіонів – гідроген-іони.
Ступінь дисоціації слабкого електроліту обернено пропорційний корню квадратному з величини молярної концентрації електроліту, тому з зменшенням концентрації розчина ступень дисоціації збільшується.
Величини Кд даються в довідниках і це є величина, постійна для кожної речовини при даній t0 . Для речовин, що мають декілька іонів Гідрогену та гідроксогруп (кислоти та основи) дисоціація перебігає в декілька ступіней і для кожного ступеня є своя Кд.
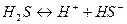 Кд1
Кд1
 Кд2
Кд2
Для сумарного процесу Кд = Кд1· Кд2 . А Кд2 > Кд1.
Це пояснюється тим, що енергія, необхідна для відриву іона від нейтральної молекули значно менша за енергію відриву іона від зарядженого іону.
Ми визначили, що поняття Кд існує для слабких електролітів. Для сильних електролітів Кд не існує, тому що в водних розчинах сильні електроліти практично повністю дисоціюють на іони.
Однак тільки дисоціацією не можна пояснити збільшення Росм розчинів електролітів і значення Росм не пропорційне кількості частинок, на які дисоціює електроліт. В доповнення до теорії Арреніуса сучасна теорія сильних електролітів виходить з електростатичної взаємодії між іонами.
Іони, що мають однакові по знаку заряди, відштовхуються один від одного, а іони, що мають різні знаки – притягаються. В результаті кожен іон оточує “атмосфера” з іонів протилежного знаку. Ця іона “атмосфера” заторможує рух іонів і це призводить до зменшення, наприклад, електропровідності розчину і створює ефект неповної дисоціації електроліту. Цей процес можна порівняти з ефектом “тролейбусу”, тобто коли ви літом їздити в ньому, то вам свободніше, а коли зимою – тісніше.
Визначений ступінь дисоціації  для розчинів сильних електролітів називають позірним ступенем дисоціації.
для розчинів сильних електролітів називають позірним ступенем дисоціації.
Якщо збільшувати концентрацію розчину сильного електроліту, то електролітична взаємодія іонів з-за зменшення відстані між ними, збільшується. Тому швидкість їх переміщення в електролітичному полі зменшується і це призводить до більшого зниження електропровідності .
Розглянемо, як дисоціюють речовини, в залежності від класу неорганічних сполук.
1) Кислоти: в розчині утворюються іони Гідрогену і кислотного залишку. Тому властивості кислот можна пов’язати з наявністю іонів гідрогену:



Кислоти – це електроліти, які при дисоціації утворюють тільки один вид катіонів – гідроген-іони.
Для слабких багатоосновних кислот дисоціація поступова . Для кожного ступеня – своя Кд .
2) Основи - це електроліти, які при дисоціації утворюють тільки одін вид аніонів – гідроксид-іони.

 Кд1
Кд1
 Кд2
Кд2
 Кд3
Кд3
Багатокислотні основи теж дисоціюють поступово Кд1> Кд2>Кд3 .
Крім типових кислот і типових основ, взаємодіючих один з одним і утворюють амфотерні основи, що взаємодіють з кислотами і основами. До них відносять Zn(OH)2, Al(OH)3, Cr(OH)3, Be(OH)2, Sn(OH)4, Pb(OH)2, амінокислоти – гліцин, аланін. В молекулах амфотерних основ міцність зв'язку між Me і Оксигеном не дуже відрізняється від міцності зв'язку між Оксигеном і Гідрогеном, тому дисоціація можлива по обом місцям зв'язку. За принципом Ле Шател’є :
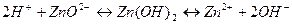
луж. серед. кисл. серед.
З рівняння видно, що в розчині існує як основа, так кислота . Амфотерні гідроксиди практично не розчиняються у воді, але розчиняються в кислотах та лугах.
Як ви пам’ятаєте, солі розподіляють на середні або нормальні, кислі і основні.