 |
|
Реакції в розчинах електролітів
Необхідно пам’ятати, що реакції в розчинах електролітів фактично проходять між іонами і супроводжуються утворенням осадів, виділенням газів або утворенням інших малодисоційованих молекул. Тому при написанні іонно-молекулярних рівнянь хімічних реакцій необхідно враховувати ступінь дисоціації і розчинність речовин. У вигляді іонів записують лише сильні електроліти, а слабкі електроліти, газоподібні леткі продукти і нерозчинні (слабко-розчинні) сполуки – в молекулярній формі.
Приклад 1. Написати в молекулярній і іонній формах рівняння взаємодії гідроксиду міді із сірчаною кислотою.
Розв’язання. В молекулярній формі
Сu(OH)2+H2SO4=CuSO4+2H2O
В іонній формі
Сu(OH)2+2H+= Cu2++2H2O
Реакцію середовища будь-якого водного розчину встановлюють за значенням водневого показника рН, десятковим логарифмом концентрації іонів водню в розчині, взятим із протилежним знаком.
рН=- lg[H+]
Аналогічно
рОН=- lg[ОH-]
Для розбавлених розчинів рН+рОН=14 при температурі 22°С.
Приклад 2. Визначити рН розчину соляної кислоти, якщо С(HCl)=0,01 моль/л.
Розв’язання. Визначаємо концентрацію іонів водню
[H+]=С · n ·a, ( 1 )
де: С – молярна концентрація кислоти, моль/л; п – число іонів водню, що утворюються із однієї молекули кислоти; a - ступінь дисоціації, в частках одиниці.
Для соляної кислоти (НСl=H++Cl-), n=1; a=1.
Концентрація іонів водню
[H+]=0,01×1×1=10-2 моль/л
рН=- lg10-2=2
Приклад 3. Визначити рН розчину H2SO4, якщо С(H2SO4)=0,01 моль/л, а a=75%.
Розв’язання. Визначаємо концентрацію іонів водню на підставі (1)
[H+]=Спa=0,01×2×0,75=1,5×10-2 моль/л
рН= - lg1,5×10-2=1,82
Приклад 4. Визначити рН водного розчину NaOH, якщоС(NaOH)=0,05 моль/л, а a=100%.
Розв’язання. Визначаємо концентрацію OH— іонів.
[ОH-]=0,05×1×1=5×10-2 моль/л
рОН=- lg5×10-2=1,3; рН=14-1,3=12,7
Для швидкого і наближеного визначення рН різних розчинів користуються індикаторами, що змінюють своє забарвлення в окресленому інтервалі рН. Найважливішими індикаторами є лакмус, метилоранж і фенолфталеїн.
Точні значення рН розчину можна дістати за допомогою спеціальних приладів - рН-метрів.
Для характеристики розчинності малорозчинних сполук використовують величину, яку називають добутком розчинності ДР:
ДР(КmAn) = [Kn+]m·[Am-]n
Гідроліз солей – обмінна реакція речовини з водою, яка приводить до утворення малорозчинних або малодисоційованих сполук (основи, кислоти, основних або кислих солей).
Необхідно добре пам’ятати:
1) гідроліз солей – процес оборотний і характеризується константою гідролізу Kг;
2) гідролізу підлягають солі утворені:
а) сильною основою і слабкою кислотою;
б) слабкою основою і сильною кислотою;
в) слабкою основою і слабкою кислотою;
3) солі, утворені сильною основою і сильною кислотою, а також солі, нерозчинні у воді, гідролізу не підлягають.
Приклад 5. Скласти рівняння гідролізу карбонату натрію Na2CO3.
Розв’язання. Сіль Na2CO3 утворена сильною основою NaОН і слабкою кислотою Н2CO3. Гідроліз буде протікати по аніону. Запишемо рівняння реакції гідролізу цієї солі:
а) дисоціація солі
Na2CO3= 
б) гідроліз аніона
І ступінь: 
ІІ ступінь: 
Отже, розчини солей, що складаються з аніонів слабких кислот і катіонів сильних основ, гідролізують з утворенням слабкої кислоти або кислої солі. Розчини таких солей мають лужну реакцію.
Приклад 6. Скласти рівняння реакцій гідролізу солі FeCl3.
Розв’язання. Сіль FeCl3 утворена слабкою основою Fe(ОН)3 і сильною кислотою НСl. Гідроліз буде протікати по катіону. Процес дисоціації FeCl3 відбувається так:

Гідроліз катіона  проходить за схемою:
проходить за схемою:
І ступінь: Fe3++HOH ↔ Fe(OH)2++H+
ІІ ступінь: 
ІIІ ступінь: 
При кімнатній температурі процес гідролізу Fe3+ йде за першим ступенем. За третім ступенем гідроліз цієї солі може йти лише при кип’ятінні.
Таким чином, солі слабких основ і сильних кислот гідролізують з утворенням слабкої основи (якщо це сіль однокислотної основи) або основних солей. При цьому утворюється вільна сильна кислота, а розчини таких солей мають кислу реакцію (рН<7).
Приклад 7. Складіть рівняння гідролізу ацетату амонію CH3COONH4.
Розв’язання. Внаслідок дисоціації цієї солі
CH3COONH4 = CH3COO -+ 
утворюється аніон слабкої кислоти і катіон слабкої основи, які гідролізуються за схемою:
CH3COO -+HOH↔ CH3COOH+OH -
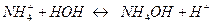
Розчин такої солі внаслідок її гідролізу може мати такі значення рН: 7, >7, <7. Ці значення визначаються константою дисоціації сильнішого електроліту (кислоти або основи). В нашому випадку розчин має рН=7, оскільки константи дисоціації гідроксиду амонію і оцтової кислоти практично однакові

Необхідно знати, що гідролізують не всі молекули, які є в розчині, а лише їх частина. Кількісно гідроліз оцінюють за ступенем і константою гідролізу.
Ступінь гідролізу h - це відношення кількості прогідролізованої солі (Сгідр), до загального числа розчинених молекул (Сзаг).
Константа гідролізу Кг – константа рівноваги реакції гідролізу, її значення не змінюється при сталій температурі
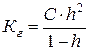
Ступінь гідролізу, як правило, невеликий і в 0,1 М розчині CH3COONa і в 0,1 М розчині NH4Cl при температурі 298 К складає біля 10-4, тобто в цих розчинах гідролізується лише одна молекула із 10000. В той самий час у гарячих розчинах гідроліз може настільки підсилитися, що пройде повний розклад солі. Це спостерігається зокрема для розчину FeCl3, в якому при нагріванні виділяється Fe(ОН)3 у вигляді колоїдних частинок.
Гідроліз деяких солей, утворених дуже слабкими кислотами, є процес необоротний, наприклад, гідроліз сульфідів і карбонатів алюмінію, хрому й заліза.
Fe2S3+6H2O=2Fe(OH)3+3H2S
Тому при взаємодії солей, що мають іони Al3+, Fe3+, Cr3+ з розчинами сульфідів і карбонатів, в осад випадають не сульфіди і карбонати цих катіонів, а їх гідроксиди.
2AlCl3+3Na2S+6H2O=2Al(OH)3¯+3H2S+6NaCl
Розчини електролітів такої самої концентрації, що й розчини неелектролітів, замерзають при нижчих температурах і киплять при вищих температурах, ніж розчини неелектролітів. При обчисленні температури замерзання й температури кипіння розчинів електролітів необхідно застосовувати такі рівняння:
Dtзам=iKкрCm; (2)
Dtкип=iKебCm; (3)
де i - ізотонічний коефіцієнт, або коефіцієнт Вант-Гоффа. Він показує, у скільки разів більше частинок електроліту утворилося у розчині порівняно з кількістю вихідних і описується відношенням:
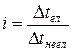 (4)
(4)
Ізотонічний коефіцієнт можна також визначити за рівнянням
i=1+a(n-1), (5)
де n – число іонів, що утворюються при дисоціації однієї молекули електроліту.
Приклад 8. Визначити температуру замерзання 5%-го розчину Na2SО4, якщо a=90%.
Розв’язання. Згідно з рівнянням (5)
i=1+0,9(3-1)=2,8;
 моль/кг.
моль/кг.
Тоді Dtзам=iKкрCm=2,8×1,83×0,37=1,93. Отже, температура замерзання розчину дорівнює -1,9°С.
Практична частина.