 |
|
Лабораторна робота № 7
РОЗЧИНИ ЕЛЕКТРОЛІТІВ ТА ГІДРОЛІЗ СОЛЕЙ
Мета роботи: ознайомлення з методами визначення водневого показника середовища та з процесами гідролізу.
Дослід 1. Залежність рН розчину ацетатної кислоти від концентрації.
Розрахунок ступеня дисоціації.
За допомогою універсального індикаторного паперу визначити рН розчину ацетатної кислоти з концентраціями 1 М і 0,01 М. Для цього скляною паличкою перенести 1-2 краплі досліджуваного розчину на універсальний індикаторний папір і порівняти забарвлення ще сирої плями з кольоровою шкалою. Записати рівняння реакції дисоціації і вираз для константи дисоціації ацетатної кислоти. Визначити ступінь дисоціації кислоти, враховуючи , що вона є слабким електролітом :
a = 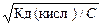 ; Кд (кисл)= 1.10-5.
; Кд (кисл)= 1.10-5.
Розрахувати рН розчинів ацетатної кислоти, передбачаючи, що концентрація іонів водню в розчині дорівнює концентраціі продисоційованих молекул :
[H+] = aC, pH = -lg[H+].
Одержані дані внести в таблицю і зробити висновок про вплив концентрації на ступінь дисоціації слабкого електроліту.
| Концентрація СН3СООН, моль/л | α | [H+] | рН розр | рН екс |
| 0,01 |
Дослід 2. Порівняння хімічної активності кислот.
В одну пробірку налити 2 мл 2 н. розчину хлоридної кислоти, в другу стільки ж 2 н. розчину ацетатної кислоти. В кожну пробірку додати по одному шматочку цинку. В якому випадку водень виділяється енергійніше? Написати іонні і молекулярні рівняння реакцій. Пояснити різницю швидкостей реакцій, які спостерігали.
Дослід 3. Вплив солі слабкої кислоти на дисоціацію цієї кислоти
В дві пробірки помістити по 1-2 мл 0,01М ацетатної кислоти і додати по одній – дві каплі індикатора метилоранжу. Одну пробірку залишити для порівняння, а в другу додати кілька кристалів натрій ацетату і добре перемішати. Порівняти забарвлення в обох пробірках і пояснити його зміни, виходячи з принципу Ле Шательє і виразу константи дисоціації ацетатної кислоти. Яку речовину треба додати до розчину слабкої кислоти, щоб змістити рівновагу в бік утворення малодисоційованих молекул?
Дослід 4. Зміщення іонної рівноваги в насиченому розчині амфотерного електроліту.
До розчину солі цинку додати краплями розбавлений розчин NaOH до утворення осаду гідроксиду цинку. Поділити осад на 2 частини. До однієї частини долити надлишок розчину хлорводневої кислоти, а до другої - надлишок концентрованого розчину лугу NaOH. Що спостерігається у першому і в другому випадках? Пояснити зміну іонної рівноваги в насиченому розчині гідроксиду цинку. Складіть рівняння реакцій розчинення гідроксиду цинку в кислотному і лужному середовищах, враховуючи, що амфотерний гідроксид погано розчиняється у воді, а у лужних розчинах утворюється комплексна сполука.
Дослід 5. Поведінка розчинів солей, утворених сильними основами і сильними кислотами.
Скляною паличкою, змоченою розчином натрій хлориду, торкнутися клаптика універсального індикаторного паперу. Визначити рН. Те ж саме зробити з розчином калій нітрату. Чи містять розчини взятих для досліду солей надлишок іонів H+ або OH–? Чи підлягають такі солі гідролізу? Пояснити, чому в розчинах цих солей рН < 7.
Дослід 6. Гідроліз солей, утворених сильними основами і слабкими кислотами.
Налити в окремі пробірки розчини натрій карбонату і натрій ацетату. Визначити реакції розчинів за допомогою індикаторів фенолфталеїну, метилоранжу і універсального індикаторного паперу. Скласти молекулярні й іонні рівняння реакцій гідролізу солей. Приклад:
К2СО3 « 2К+ + СО3 2– Гідролізу підлягає іон слабкого електроліту СО32–
СО3 2– + Н – ОН « НСО3– + ОН – коротке (іонне) рівняння гідролізу
К2СО3 + НОН « КНСО3 + КОН; повне (молекулярне) рівняння гідролізу; рН > 7.
Пояснити, чому не відбувається друга стадія процесу.
Написати вираз для константи гідролізу Na2CО3 і CH3COONa. Розрахувати константи гідролізу и ступінь гідролізу для 0,1 М розчину солі CH3COONa, Kд(CH3COOН) = 1.10–5.
Дослід 7. Гідроліз солі, утвореної слабкою основою і сильною кислотою
Налити в окремі пробірки розчини солей магній сульфату і алюміній сульфату. Визначити середовище та рН розчинів солей за допомогою індикатора метилоранжу та універсального індикаторного паперу. Написати рівняння гідро-лізу і вирази констант гідролізу для цих солей.
Розрахувати константу та ступінь гідролізу 0,1 М розчину MgSO4 ,Kд2(Мg (ОН)2) = 2,5.10–3.
Дослід 8. Зміщення рівноваги реакції гідролізу при зміні температури.
В пробірку налити 5 - 6 мл розчину натрій ацетату і одну - дві краплі індикатора фенолфталеїну. Вміст пробірки поділити на дві частини, одну з них залишити для порівняння, другу пробірку опустити до водяної бані і нагріти. Порівняти забарвлення індикатора в обох пробірках. Скласти рівняння реакції гідролізу солі. Зробити висновок про вплив температури на зміщення рівноваги згідно з принципом Ле Шательє, враховуючи, що гідроліз - реакція ендотермічна.
Дослід 9. Незворотний процес гідролізу.
З таблиці розчинності виявити солі, що не існують у розчині, тобто підлягають повному (незворотному) гідролізу. До 4-5 крапель алюміній сульфату додати стільки ж розчину натрій карбонату. Спостерігати утворення осаду і пухирців газу. Який газ і який осад утворюються у цьому досліді?
Написати іонні та молекулярні рівняння гідролізу.