 |
|
Методика виконання роботи
Робота 1. Визначення константи електродної посудини.
Визначення константи електродної посудини проводять за допомогою розчину електроліту, для якого відоме значення питомої електропровідності. З цією метою використовують, як правило, 0,01 М розчин Ксl, для якого при 20 0С 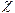 = 1,25 × 10-3 См/м.
= 1,25 × 10-3 См/м.
В посудину для визначення електропровідності наливають такий об’єм 0,01 М розчину Ксl , щоб електроди були повністю занурені в розчин. За допомогою омметра замірюють опір розчину в посудині і за формулою К = R× 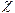 вираховують її константу.
вираховують її константу.
Робота 2. Визначення електропровідності розчинів слабих електролітів та біологічних рідин.
Визначивши постійну (константу) електродної посудини, останню старанно промивають дистильованою водою, наливають в неї відповідний досліджуваний розчин слабкого електроліту і вимірюють опір. Одержані дані заносять у таблицю:
| № п/п | Досліджуваний розчин | R | 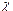
| 
|  
|
| 1 | 0,1 М НСООН | ||||
| 2. | 0,1 М СН3 СООН | ||||
| 3. | 0,1 М ССl3 COOH | ||||
| 4. | 0,1 М NH4 OH | ||||
| 5. | Шлунковий сік (1:10) | - | |||
| 6. | Сироватка крові (1:5) | - |
Використовуючи знайдені величини опору досліджуваних розчинів і постійну електродної посудини (K) розраховують питому електропровідність :
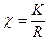
і молярну електропровідність :
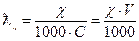 де:
де: 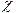 - питома електропровідність
- питома електропровідність
С - молярна концентрація
V – розведення, 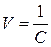
Для розчинів слабких електролітів розрахувати також граничну молярну електричну провідність, використовуючи дані довідника про електролітичну рухливість відповідних іонів :

Результати занести в таблицю і зробити висновок.
Робота 3.Порівняння сили електролітів на основі електропровідності їх розчинів.
Використовуючи дані із роботи № 2 про молярну електропровідність і граничну електропровідність відповідних розчинів електролітів, розраховують ступінь і константу дисоціації.
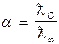 ; К=
; К= 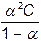
Дані занести у таблицю і зробити висновок про силу різних електролітів і як впливає введення хлору в радикал кислоти на її силу.
| № п/п | Досліджуваний розчин |  a a
| К |
| 1 | 0,1 М НСНОН | ||
| 2. | 0,1 М СН3 СООН | ||
| 3. | 0,1 М ССl3 COOH | ||
| 4. | 0,1 М NH4 OH |
Заняття 7
Тема: Адсорбція електролітів. Хроматографія та її застосування в біології та медицині
Актуальність теми:Адсорбційні явища на твердих адсорбентах широко використовуються в медицині. Переважна більшість процесів у живому організмі проходить на межі поділу фаз і їх швидкість на ряду із іншими факторами визначається площею поверхні. При гемосорбції кров очищається від токсинів середньої молекулярної маси пропусканням її через адсорбенти – активоване вугілля різних марок, що широко використовується в реанімаційних відділеннях лікарень. Ентеросорбція є використання активованого вугілля для зв’язування токсинів в шлунково-кишковому тракті. Адсорбція органічних барвників на поверхні біологічних препаратів використовується в гістології. Розділення суміші речовин має надзвичайно важливе значення для дослідження речовин, які складають організм і приймають участь в процесах життєдіяльності.
Найбільш ефективний метод розділення речовин дістав назву хроматографічного. Цей метод набуває чимраз ширшого застосування і для деяких сумішей є єдино можливим методом. Великий набір хроматографічних методів від простих і доступних (на папері) до складних автоматизованих методів дозволяє використовувати їх в сучасній науці, особливо для наукових досліджень в біології і медицині.
Навчальні цілі:
Знати: механізми адсорбційних процесів на границі розділу фаз, теорію молекулярної адсорбції, кількісне визначення адсорбції, принципи розділення суміші речовин за адсорбційним і розподільним механізмом, а також суть рідинної, газової, капілярної, колонкової, тонкошарової хроматографії.
Вміти: Вивчити закономірності адсорбції на каоліні кислотних і основних барвників, а також залежність адсорбції від рН розчину, провести розділення суміші катіонів нисхідною хроматографією на колонці і висхідною хроматографією на папері.