 |
|
Тема 4: Химическая связь и строение молекул
При взаимодействии атомов между ними возникает химическая связь, приводящая к образованию устойчивой многоатомной системы (молекулы, молекулярного иона, кристалла). Химическая связь осуществляется с помощью электронов. Причина её возникновения обусловлена тем, что образование молекулы сопровождается выигрышем энергии.
Различают ковалентную, ионную и металлическую связи.
Связь, образованную общими электронными парами, называют ковалентной. Основные свойства ковалентной связи: насыщаемость, направленность, поляризуемость. Насыщаемость ковалентной связи объясняется наличием у атома того или иного элемента определенного числа неспаренных электронов (валентностью). У большинства элементов число валентных электронов может изменяться в зависимости от того, находится атом в нормальном или возбужденном состоянии.
Направленность ковалентной связи обуславливается тем, что электронные облака атома имеют определенную конфигурацию (s-, p-, d- облака) и расположение в пространстве. По способу перекрывания электронных облаков различают 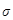 - и
- и  - связи.
- связи.
Поляризуемость ковалентной связи объясняется различной электроотрицательностью образующих молекулу атомов. Электронная пара сдвигается к более электроотрицательному атому. Различают полярную и неполярную ковалентную связи.
Ковалентная связь образуется также по донорно-акцепторному способу: за счет неподеленной электронной пары одной из частиц (донора) и свободной квантовой ячейки другого атома (акцептора). Этот тип связи имеет место в комплексных соединениях.
Ионная связь. Чем больше различие в электроотрицательности двух элементов, тем более полярна химическая связь между их атомами. Ионный тип связи можно рассматривать как крайний случай полярной ковалентной связи и образуется между атомами типичных металлов и неметаллов: СsF, NaCl, CaO.
Атомы типичных металлов отдают электроны (катионы), а атомы типичных неметаллов принимают электроны (анионы). В результате электростатического притяжения между катионом и анионом образуется молекула.
Ионная связь в отличие от ковалентной, характеризуется ненаправленностью и ненасыщенностью.
Для металлов характерна металлическая связь, объясняющая особенности кристаллической структуры металлов и их характерные свойства (высокую тепло- и электропроводность).
В межмолекулярных взаимодействиях проявляется водородная связь, обусловленная способностью иона водорода внедряться в электронные оболочки соседних электроотрицательных атомов. Она возникает между атомами, имеющими свободную электронную пару, и водородом, который связан с другим атомом полярной ковалентной связью, например:
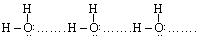
Существует два метода описания химических связей: метод валентных связей (ВС), согласно которому в образовании химических связей участвуют только валентные электроны и метод молекулярных орбиталей (МО), согласно которому в образовании связей участвуют все электроны всех атомов, входящих в молекулу. Поэтому химическая связь в методе МО является многоцентровой по количеству ядер атомов, входящих в состав молекулы. Все электроны, вращаясь по сложным молекулярным орбиталям, связывают атомы в молекулу. В простейшем приближении молекулярная орбиталь является линейной комбинацией атомных орбиталей.
Контрольные задания:
61. Что такое ионная связь? Приведите примеры. Разберите образование оксида кальция с точки зрения перестройки электронных структур кальция и кислорода.
62. Определите тип химической связи в молекулах NaCl, HCl, Cl2. Для двух последних приведите схему перекрывания электронных облаков.
63. Что такое ковалентная связь? Приведите схему перекрывания электронных облаков при образовании молекул Н2 и Н2О.
64. Что такое насыщаемость ковалентной связи? Распределите электроны внешнего энергетического уровня атома хлора по квантовым ячейкам. Как объясняет спиновая теория наличие у хлора нечетной переменной валентности?
65. Что такое направленность ковалентной связи? Объясните почему молекула BF3 имеет симметричную треугольную форму?
66. Что такое 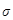 - и
- и  - связи? Разберите, сколько
- связи? Разберите, сколько 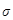 - и
- и  - связей в молекуле азота. Приведите схему перекрывания электронных облаков в этой молекуле.
- связей в молекуле азота. Приведите схему перекрывания электронных облаков в этой молекуле.
67. Что такое гибридизация атомных орбиталей? Как метод ВС объясняет тетраэдрическое строение молекулы метана СН4?
68.Какой тип связи осуществляется в кристаллах металлов? Чем отличается структура кристаллов NaCl от структуры кристаллов Na? Какой вид связи осуществляется в этих кристаллах? Какие кристаллические решетки имеют натрий и NaCl?
69. Какую химическую связь называют водородной? Между молекулами каких веществ она образуется? Почему H2O и HF, имея меньшую молекулярную массу, плавятся и кипят при более высоких температурах, чем их аналоги?
70.Какую химическую связь называют координационной или донорно-акцепторной? Разберите строение комплексного иона [NH4]+. Укажите донор, акцептор. Как метод ВС объясняет тетраэдрическое строение этого иона?
71. Что такое гибридизация атомных орбиталей? Как метод ВС объясняет линейное строение молекулы BeCl2? Приведите схему перекрывания электронных облаков.
72. Составьте электронные схемы строения молекул Cl2, H2S, N2. В каких молекулах ковалентная связь является полярной? Как метод валентных связей (ВС) объясняет угловое строение молекулы H2S?
73. Какую валентность, обусловленную неспаренными электронами, может проявить фосфор в нормальном и возбужденном состояниях?
74. Какую химическую связь называют координационной или донорно-акцепторной? Разберите строение комплексного иона [BF4]-. Укажите донор, акцептор. Как метод ВС объясняет тетраэдрическое строение этого иона?
75. Какие кристаллические структуры называют ионными, атомными, молекулярными и металлическими? Приведите по одному примеру. Как зависят свойства кристаллических веществ от типа химической связи?
76. Что такое спин-валентность? Объясните с позиций метода ВС, почему Cl имеет переменную валентность, а фтор – постоянную.
77. Какую химическую связь называют ковалентной? Чем можно объяснить направленность ковалентной связи? Как метод валентных связей (ВС) объясняет строение молекулы воды?
78. Какую ковалентную связь называют полярной? Что служит количественной мерой полярности ковалентной связи? Исходя из значений электроотрицательности атомов соответствующих элементов, определите, какая из связей: HCl, ICl, BrF - наиболее полярна.
79. Какую ковалентную связь называют 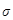 - связью и какую
- связью и какую  -связью? Разберите на примере строения молекулы азота.
-связью? Разберите на примере строения молекулы азота.
80. Распределите электроны атома серы по квантовым ячейкам. Чему равна валентность серы, обусловленная неспаренными электронами?