 |
|
Основания Бренстеда.
Для оснований Бренстеда действуют те же закономерности, что и для кислот. Также рассматривается кислотно-основная реакция, которая приводит к образованию сопряженной кислоты:
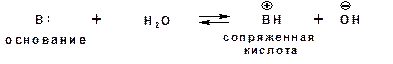
Константу равновесия обозначают как Кb

Чем больше Кb , тем выше сила основания.
Более универсальной оценкой силы органического основания, является рКа его сопряженной кислоты - рКа(ВН+):

Соответствующая константа и рК:

Слабым основаниям соответствуют сильные сопряженные кислоты и наоборот: сильным основаниям соответствуют слабые сопряженные кислоты. Типичными органическими основаниями по Бренстеду являются амины. При этом алифатические амины значительно более сильные основания, чем ароматические.

В молекуле анилина НЭП атома азота сопряжена с π-электронами бензольного кольца. Этот эффект повышает силу его сопряженной кислоты и соответственно снижает основность анилина по сравнению с метиламином:

Для сопряженной кислоты можно нарисовать резонансные структуры, следовательно сопряженная кислота устойчивая, а соответствующее основание слабое.

В молекуле метиламина НЭП полностью локализована на атоме азота. Это способствует снижению силы его сопряженной кислоты, а, следовательно, повышает основность метиламина.
Кислоты Льюиса:
Кислота Льюиса – это любая молекула или частица, способная принимать (акцептировать) электроны на вакантную орбиталь. В качестве вакантной орбитали выступает, как правило, низшая свободная молекулярная орбиталь (НСМО). НСМО может быть π- и σ-орбиталь. Соответственно среди кислот Льюиса различают π- σ-кислоты. Кислотами Льюиса могут быть частицы и молекулы не несущие электрического заряда:
BF3; AlCl3; AlBr3;FeCl3; ZnCl2; SnCl4; TiCl3; TiCl4..
Частицы несущие положительный заряд (катионы):

σ-Кислотой является протон. Большинство кислот Льюиса являются π-кислотами. К π-кислотам относятся алкены и арены имеющие электроноакцепторные заместители. Например:

Основания Льюиса.
Основаниями Льюиса являются любые частицы, способные выступать в роли доноров пары электронов. Как правило, донорной орбиталью явояется высшая занятая молекулярная орбиталь (ВЗМО). В зависимости от характера ВЗМО различают:
1. π-доноры (π-основания)
2. n-доноры (n -основания)
3. σ- доноры (σ -основания)
В π-донорах высшей занятой молекулярной орбиталью является π-орбиталь. Примерами π-доноров являются алкены, сопряженные алкадиены, бензол и его производные, другие арены.
В n-донорах донорной орбиталью является орбиталь, заселенная НЭП. Примерами n -доноров являются спирты, амины, алкоксид-анионы, амид-анионы.
В σ-донорах высшей занятой молекулярной орбиталью является σ –орбиталь. Свойства σ -доноров проявляют алканы в реакциях с участием сверхкислот и комплексов переходных металлов.