 |
|
Расчет материального баланса.
Азотная кислота.
Чистая азотная кислота HNO  —бесцветная жидкость плотностью 1,51 г/см
—бесцветная жидкость плотностью 1,51 г/см  при - 42 °С застывающая в прозрачную кристаллическую массу. На воздухе она, подобно концентрированной соляной кислоте, «дымит», так как пары ее образуют с 'влагой воздуха мелкие капельки тумана,
при - 42 °С застывающая в прозрачную кристаллическую массу. На воздухе она, подобно концентрированной соляной кислоте, «дымит», так как пары ее образуют с 'влагой воздуха мелкие капельки тумана,
Азотная кислота не отличается прочностью. Уже под влиянием света она постепенно разлагается:

Чем выше температура и чем концентрированнее кислота, тем быстрее идет разложение. Выделяющийся диоксид азота растворяется в кислоте и придает ей бурую окраску.
Азотная кислота принадлежит к числу наиболее сильных кислот; в разбавленных растворах она полностью распадается на ионы Н  и- NO
и- NO 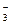 .
.
Современные промышленные способы получения азотной кислоты основаны на каталитическом окислении аммиака кислородом воздуха. При описании свойств аммиака было указано, что он горит в кислороде, причём продуктами реакции являются вода и свободный азот. Но в присутствии катализаторов - окисление аммиака кислородом может протекать иначе. Если пропускать смесь аммиака с воздухом над катализатором, то при 750 °С и определенном составе смеси происходит почти полное превращение аммиака в оксид азота 2 и воду. Образовавшийся 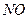 легко переходит в
легко переходит в  , который с водой в присутствии кислорода воздуха дает азотную кислоту.
, который с водой в присутствии кислорода воздуха дает азотную кислоту.
В качестве катализаторов при окислении аммиака используют сплавы на основе платины.
Получаемая окислением аммиака азотная кислота имеет концентрацию, не превышающую 60%. При необходимости ее концентрируют,
Промышленностью выпускается разбавленная азотная кислота концентрацией 55, 47 и 45%, а концентрированная—98 и 97%, Концентрированную кислоту перевозят в алюминиевых цистернах, разбавленную — в цистернах из кислотоупорной стали.
1.2. Физико-химические характеристики основных стадий процесса.
Кристаллизация
Кристаллизация – процесс перехода из раствора (или расплава) в твердое состояние – является широко распространенным методом получения компонентов в чистом виде. Это обусловлено тем, что из-за различной растворимости отдельных веществ и различия из концентраций в исходных растворах всегда можно подобрать такие условия кристаллизации, при которых получается чистый продукт, а нежелательные примеси остаются в маточном растворе.
Характерной особенностью кристаллов является строго определенное расположение атомов, ионов или молекул в узлах кристаллической решетки. От этого зависит симметрия кристаллов, их принадлежность к той или иной кристаллографической системе, а в значительной степени и их внешняя форма. Параметры кристаллической решетки определяются размерами атомов (ионов, молекул), величиной и направлением сил взаимодействия между ними.
Кристаллизация сопровождается явлениями полиморфизма, образования кристаллогидратов, изоморфизма.
Статика кристаллизации.
Статика кристаллизации, как и статика растворения, определяется растворимостью вещества. Раствор, в котором кристалл не может ни расти, ни растворятся, называется насыщенным, а его концентрация – концентрацией насыщения, или растворимостью. Растворы с меньшей концентрацией называют ненасыщенными, а с более высокой – пересыщенными.
Характер изменения растворимости в зависимости от температуры определяется величиной и знаком теплового эффекта – теплотой кристаллизации (растворения). При переходе молекул (атомов, ионов) из раствора в кристалл они становятся менее подвижными и теряют часть своей энергии, которая выделяется в виде теплоты образования кристаллической решетки. С другой стороны, прежде чем включиться в решетку, им необходимо разорвать свои связи с молекулами растворителя, на что затрачивается энергия десольватации (в водных растворах – дегидратации). В зависимости от того, какой из этих процессов характеризуется большей энергией, суммарный тепловой эффект может быть либо положительным, либо отрицательным. В большинстве случаев при кристаллизации тепло выделяется. Но иногда, например, при кристаллизации некоторых безводных сульфатов из водных растворов, тепло, наоборот, поглощается.
В справочниках теплота кристаллизации обычно не приводится. Поэтому при технических расчетах пользуются значениями теплоты растворения, которая практически равна теплоте кристаллизации с обратным знаком.
Методы кристаллизации.
Для осуществления кристаллизации необходимо создать пересыщенное состояние раствора. Наиболее универсальным способом создания пересыщения является удаление растворителя выпариванием. Так как насыщенный раствор кипит при постоянной температуре, то этот метод называют изотермической кристаллизацией. Он является единственным рациональным способом выделения веществ из раствора, если их концентрация насыщения мало уменьшается (NaCl) или увеличивается (Na2SO4) при уменьшении температуры. Если же растворимость вещества существенно уменьшается при понижении температуры (CuSO4 * 5H2O, KCl, NaNO3), то кристаллизацию можно осуществить и без удаления растворителя простым охлаждением. Этот метод получил название изогидрической кристаллизации. При самоиспарении горячего концентрированного раствора под вакуумом или в токе газа оба эти метода комбинируются. Пересыщение создается здесь одновременно вследствие и испарения растворителя, и охлаждения раствора.
Помимо этих наиболее распространенных методов кристаллизацию можно вызывать высаливанием, т. е. введением в насыщенный раствор добавок, понижающих растворимость основного вещества или химически связывающих растворитель.
В ряде производств необходимое для кристаллизации пересыщение возникает в результате химической реакции.
Центрифугирование.
Разделение жидких неоднородных систем при помощи центробежной силы может быть проведено либо фильтрованием в фильтрующих центрифугах, либо отстаиванием в отстойных центрифугах или в сепараторах для эмульсий. Основной частью центрифуг является быстро вращающийся барабан: дырчатый, т. е. с отверстиями, покрытый изнутри дренажной сеткой, если необходимо, и фильтровальной тканью у фильтрующих центрифуг, и сплошной, т. е. без отверстий у отстойных центрифуг.
При фильтровании жидкость протекает через пористую перегородку, которая задерживает твердые частицы. Накапливающийся осадок представляет, в отличии от текучего шлама отстойников, неподвижную массу (лепешку) с влажностью 7÷20%. Таким образом, фильтрование всегда дает более полное обезвоживание осадка и более чистую осветленную жидкость (фильтрат), чем отстаивание.
Выбор материала фильтровальных перегородок зависит от размера частиц в пульпе и требуемой чистоты фильтрата, коррозионной активности пульпы, способа фильтрования и т. д. При фильтровании нейтральных и слабощелочных сред чаще применяются хлопчатобумажные ткани (фильтродиагональ, фильтробельтинг), кислых сред – шерстяные ткани (грубошерстные сукна). Благодаря ворсистому строению, ткани способны задерживать частицы, размеры которых меньше размеров пор ткани. В качестве материала для фильтрующих перегородок применяются также металлические сетки, синтетические волокна (капрон, хлорин, нитрон, лавсан), пористая резина, асбестовая и стеклянная ткань и др. При фильтровании пульп, содержащих очень мелкие частицы (менее 1мкм), иногда применяют «намывные» фильтровальные перегородки из бумажной массы, активированного угля, асбеста и др., которые адсорбируют на своей поверхности эти мелкие частицы (или добавляют названные материалы в пульпу).
Сушка.
Обезвоживание материала производится с целью повышения качества готового продукта, предупреждения слеживаемости, удешевление его транспортировки. Обезвоживание топлива, например, повышает его теплотворную способность и температуру горения.
Удаление влаги производится двумя способами: механическим – путем фильтрования, прессования, центрифугирования (однако этим способом нельзя полностью удалить влагу) и тепловым – путем испарение влаги, т. е. сушкой.
Вследствие большой величины теплоты порообразования r (2100 -2500 кДж/кг или 500 – 600 ккал/кг) высушивание, как и выпаривание, является сравнительно дорогой операцией. Поэтому перед сушкой необходимо предварительное, возможно полное, обезвоживание материала более дешевым механическим сбособом.
1.3. Характеристика используемых химических реакторов.
Химические реакторы.
Химическим реактором называется аппарат, в котором осуществляется химикотехнологический процесс сочетающий массо-, тепло-, импульсоперенос с одновременным протеканием химической реакции.
Испарительные кристаллизаторы.
Испарительные кристаллизаторы можно разделить на кристаллизаторы с воздушным охлаждением и вакуум-кристаллизаторы.
В кристаллизаторах с воздушным охлаждением происходит охлаждение раствора в результате испарения растворителя (воды), так как упругость пара, соответствующая температуре исходного раствора, больше парциального давления пара в воздухе и передачи воздуху физического тепла, так как температура исходного раствора выше температуры окружающего воздуха.
В вакуум-кристаллизаторах создается пониженное давление путем конденсации пара и удаления неконденсирующихся газов с помощью вакуум-насоса. Когда остаточное давление в аппарате меньше упругости пара, сответствующей температуре раствора,этот раствор оказывается в перегретом состоянии. Он вскипает по всему объему и в результате испарения части растворителя охлаждается до температуры кипения раствора при данном остаточном давлении. Вследствие того, что здесь нет внешнего источника тепловой энергии, как в выпарных аппаратах, на испарение расходуется физическое тепло самого раствора. Отсутствие теплопередающих поверхностей позволяет изготавливать их из любых коррозионно-стойких материалов, в том числе обладающих малой теплопроводностью, или облицовывать их изнутри защитными покрытиями (резиной, пластмассами, кислотостойкими плитками и т. д.). Большим достоинством вакуум-кристаллизаторов является их герметичность.

В барабанном кристаллизаторе с воздушным охлаждением раствор и холодный воздух противотоком движутся внутри вращающегося барабана 1. Для уменьшения инкрустаций внутренних стенок барабан снаружи теплоизолируются или помещается в кожух 2 с трубой 3 для парового обогрева.
Вследствие снижения скорости охлаждения в барабанных кристаллизаторах с воздушным охлаждением получают более крупнокристаллический продукт по сравнению с продуктом из аппаратов с водяным охлаждением. Однако и в них наблюдается склонность к инкрустациям. Причина этого состоит в резком охлаждении воздухом пленки раствора в верхней части внутренней поверхности вращающегося барабана.
1.4. Характеристика конечных продуктов.
Нитрат калия.
Физико-химические свойства
Нитрат калия KNO3 (калиевая селитра) представляет собой безводную кристаллическую соль белого цвета (иногда с желтовато-сероватым оттенком), плотностью 2,11 г/см3, плавящуюся при 3340. Выше 3380 разлагается на нитрит калия и кислород. Известны две кристаллические модификации KNO3: при низких температурах образуются кристаллы ромбической формы, при более высоких температурах – ромбоэдрические кристаллы. Растворимость KNO3 в воде (в г/100 г Н2О): при 20о – 31,5; 30о – 45,6; 40 – 63,9; 60 – 109,9; 114 – 312.
В растворах азотной кислоты растворимость KNO3 с увеличением концентрации кислоты понижается, достигает минимума, затем возрастает; минимальная растворимость KNO3 при 50о равна 24,91 % при содержании в растворе 27,63 % НNO3 и 47,46% Н2О.
Применение.
Нитрат калия используют для производства порохов, в пиротехнике, в пищевой и стекольной промышленности и как удобрение. К преимуществам нитрата калия по сравнению со многими другими удобрениями относятся: отсутствие балласта, что особенно важно при дальних перевозках и малая гигроскопичность.
Согласно ГОСТ 1949 – 65, к качеству калиевой селитры предъявляются следующие требования (в %):
| Сорт 1-й | Сорт 2-ой | Сорт 3-ий | |
| KNO3 (в пересчете на сухой продукт), не менее………………………………………. | 99,8 | 99,5 | 98,0 |
| Влага, не более……………………………. | 0,1 | 0,2 | 2,0 |
| Хлористые соли (в пересчете на NаСl), не более………………………………………. | 0,03 | 0,1 | Не норми-руется |
| Углекислые соли (в пересчете не K2СO3), не более……………………………………. | 0,02 | 0,04 | То же |
| Не растворимый в воде остаток, не более.. | 0,03 | 0,03 | » » |
| Не растворимый в соляной кислоте прокаленный остаток, не более…………... | 0,005 | 0,02 | » » |
| Окисляемые вещества, не более………….. | 0,01 | Не норми-руется | » » |
| Соли кальция и магния (в пересчете на кальций), не более………………………… | 0,02 | 0,025 | » » |
Калиевая селитра, предназначаемая для производства порохов, должна содержать солей кальция и магния не более 0,002%.
Качество аттестованного продукта регламентировано ГОСТ 5.1138 – 71; он должен содержать в сухом веществе не менее 99,9% KNO3; содержание примесей не должно превышать: влаги – 0,08%, хлоридов (NаСl) – 0,017, карбонатов (K2СO3) – 0,01%, не растворимого в воде остатка – 0,01%, не растворимого в соляной кислоте прокаленного остатка – 0,004%, веществ, окисляемых марганцовокислым калием (в пересчете на KNO2) – 0,01%, солей Са и Mg (в пересчете на Са) – 0,002%.
Способы производства нитрата калия.
Нитрат калия в природе встречается в виде небольших залежей. Искусственным способом, известным с давних времен, калиевую селитру получали в так называемых селитряницах из компостов, в которые входили навоз, зола, известь, хворост и др. В результате биохимических процессов с течением времени в таких компостах образовывалась калиевая селитра, которую выщелачивали водой и подвергали кристаллизации; при этом получался сравнительно чистый продукт.
Получение нитрата калия нейтрализацией щелочей азотной кислотой вследствие необходимости затраты дорогого сырья – едкого кали или поташа и азотной кислоты осуществляют редко. Для нейтрализации берется 30 -35% раствор КОН и 50%-ая кислота или сухой поташ, содержащий 85 -87% К2СО3 и около 5% КНС3, и 25 -30% -ная азотная кислота. Полученный раствор, содержащий около 30% КNО3, выпаривают при 110 -120о , отфильтровывают от примесей на фильтрпрессе и направляют на кристаллизацию. Кристаллы отфуговывают и высушивают.
Способ получения нитрата калия абсорбцией калиевыми щелочами нитрозных газов также применяется в ограниченных масштабах из-за дефицитности едкого кали и особенно поташа. Процесс этот аналогичен описанному выше процессу получения нитрата натрия абсорбцией нитрозных газов содой. При подаче на абсорбцию раствора едкого кали отбираемый из первой абсорбционной башни щелок содержит 350 -400 г/л КNО2, 80 -100 г/л КNО3 и 2 -3 г/л КОН. Инверсия проводится при 70 -80о с избытком азотной кислоты до 30 г/л.
Наибольшее промышленное распространение имеет конверсионный способ получения нитрата калия. Представляет интерес получение его из окислов азота и хлористого калия.
Расчет материального баланса.
Введем некоторые упрощения для расчета. Будем считать, что после кристаллизации у нас образуется конечный продукт, а также примем, что в реактор не добавляют маточный раствор. Но на самом деле после кристаллизации идет фильтрование и промывка кристаллов, а затем сушка.
Молярные массы веществ.
| Вещество | Молярная масса |
| НCl | 36,5 |
| KNO3 | |
| NaNO3 | |
| КCl | 74,5 |
| НNO3 | |
| NOCl | 65,5 |
| Cl2 | |
| NaCl | 58,5 |
1. Стадия кристаллизации.

Так как в конечном итоге мы должны получить 1 кг конечног продукта 1-ого сорта:
m(КNО3) = 998 г
m(NaCl)= 0,3 г
m(H2O)=1 г
примеси – 0,7 г
Исходный раствор содержит КNО3 34,2%, а маточный раствор содержит КNО3 9,1%.
Обозначим за х – массу исходного раствора, а за у – массу маточного раствора, тогда составим уравнения:
0,342*х=998+0,091*у
х=1000+у
Решая эти уравнения совместно получим: у=2613,5 г; х=3613,5 г
Зная концентрации КNО3, HCl, HNO3:
ω(КNО3)=0,091
ω(HCl)=0,074
ω(HNO3)=0,038
найдем массы этих веществ в маточном растворе.
m(HCl)=0,074*2613,5=193,4 г
m(КNО3)=0,091*2613,5=237,8 г
m(HNO3)=0,038*2613,5=99,3 г
Так же в маточном растворе у нас находится NaNO3 и H2O. Определим количество NaNO3. Для этого нам необходимо узнать сколько было исходного продукта, а точнее сколько было NaNO3.
Расчитаем количество KNO3 в исходном растворе.
m(КNО3)=0,342*3613,5=1235,8 г
Тогда по реакции КCl + HNO3 = KNO3 + НCl
m(КCl)=1235,8*74,5/101=911,5 г
m1(HNO3)=911,5*63/74,5=770,8 г
m1(НCl)=911,5*36,5/74,5=446,6 г
Найдем массу NaCl в исходном сырье.
m(КCl)= 911,5 г – 90%
m(NaCl)=х - 10%
m(NaCl)=911,5*10/90=101,3 г
Тогда масса исходного сырья mисх=911,5+101,3=1012,8 г прибавим сюда не участвующие в процессе примеси 0,7 г, mисх=1013,5
Пусть эти примеси останутся в NaCl, тогда m(NaCl)=102 г
Теперь рассмотрим реакцию
NaCl + HNO3 = NaNO3 + НCl
Так как в конечном продукте остается 0,3 г NaCl, то прореагирует 101,7 г NaCl, поэтому расчет будем вести на 101,7 г NaCl.
m2(HNO3)=101,7*63/58,5=109,5 г
m(NaNO3)=101,7*85/58,5=147,8 г
m2(НCl)=101,7*36,5/58,5=63,5 г
Теперь зная m(NaNO3)=147,8 г найдем массу воды в маточном растворе
m(H2O)=2613,5-193,4-237,8-99,3-147,8=1935,2 г
Теперь мы можем составит таблицу материального баланса кристаллизации.
Материальный баланс процесса кристаллизации.
| Приход | Расход | ||||
| Статья прихода | количество, г | Статья расхода | количество, г | ||
| поток | компонент | поток | компонент | ||
| Исходный раствор, в том числе KNO3 HNO3 HCl NaCl Примеси H2O NaNO3 | 3613,5 | 1235,8 99,3 193,4 0,3 0,7 1936,2 147,8 | Конечный продукт, в том числе KNO3 NaCl H2O Примеси Маточный раствор, в том числе HCl KNO3 HNO3 H2O NaNO3 | 2613,5 | 0,3 0,7 193,4 237,8 99,3 1935,2 147,8 |
| Итого: | 3613,5 | 3613,5 | Итого: | 3613,5 | 3613,5 |
Расчет материального баланса в реакторе.
Так как выше мы посчитали количество НCl по 1 и 2-ой реакции найдем массу НCl, которая образовалась в результате этих реакций.
m(НCl)=446,6+63,5=510,1 г
но так как в конечном растворе остается 193,4 г НCl, то на (3) реакцию идет 510,1-193,4=316,7 г НCl.
Рассмотрим (3) реакцию
3НCl+ HNO3=NOCl+Cl2+2H2O
Рассчитаем массу азотной кислоты исходя из того, что m(НCl)=316,7 г
m3(HNO3)=316,7*63/(3*36,5)=182,2 г
Тогда m(NOCl)=316,7*65,5/(3*36,5)=189,4 г
m(Cl2)=316,7*71/(3*36,5)=205,3 г
m(H2O)=316,7*2*18/(3*36,5)=104,1 г
Найдем массу m∑(HNO3)= m1(HNO3)+ m2(HNO3)+ m3(HNO3)=770.8+109,5+ +182,2=1062.5 г
Найдем массу раствора азотной кислоты, учитывая что она у нас 40%.
Mраст(HNO3)=1062,5*100/40=2656,25 г
Тогда масса воды пришедшей с кислотой m(H2O)=2656,25-1062,5=1593,75 г
Так как в результате реакции (3) у нас выделилось воды 104,1 г, а также с азотной кислотой пришло воды 1593,75 г ,то острый пар принес воды 4007,6-1013,5-2656,25=337,35 г.
Материальный баланс реактора.
| Приход | Расход | ||||
| Статья прихода | количество, г | Статья расхода | количество, г | ||
| поток | компонент | поток | компонент | ||
| Исходное сырье, в том числе NaCl КCl Азотная кислота, в том числе HNO3 H2O Острый пар, в том числе H2O | 1013,5 2656,25 337,35 | 911,5 1062,5 1593,75 337,35 | Конечный раствор, в том числе KNO3 HNO3 HCl NaCl Примеси H2O NaNO3 Выделяющиеся газы, в том числе NOCl Cl2 | 3613,5 394,1 | 1235,8 99,3 193,4 0,3 0,7 1936,2 147,8 189,1 |
| Итого: | 4007,6 | 4007,6 | Итого: | 4007,6 | 4007,6 |
Составим общую таблицу материального баланса
| Приход | Расход | ||||
| Статья прихода | количество, г | Статья расхода | количество, г | ||
| поток | компонент | поток | компонент | ||
| Исходное сырье, в том числе NaCl КCl Азотная кислота, в том числе HNO3 H2O Острый пар, в том числе H2O | 1013,5 2656,25 337,35 | 911,5 1062,5 1593,75 337,35 | Конечный продукт, в том числе KNO3 NaCl H2O Примеси Маточный раствор, в том числе HCl KNO3 HNO3 H2O NaNO3 Выделяющиеся газы, в том числе NOCl Cl2 | 2613,5 394,1 | 0,3 0,7 193,4 237,8 99,3 1935,2 147,8 189,1 |
| Итого: | 4007,6 | 4007,6 | Итого: | 4007,6 | 4007,6 |
Расчет теплового баланса.
Теплоемкости веществ
| Температура | Вещество | Теплоемкость, кДж/кг*оС | Массовая концентрация |
| NaCl | - | 0,0003 | |
| КNO3 | 1,736 | 0,34 | |
| HNO3 | 4,253 | 0,03 | |
| НCl | 3,017 | 0,05 | |
| NаNO3 | 3,87 | 0,04 | |
| H2O | 4,609 | 0,54 | |
| HCl | 2,556 | 0,075 | |
| КNO3 | 1,24 | 0,091 | |
| HNO3 | 4,189 | 0,038 | |
| NаNO3 | 2,46 | 0,056 | |
| H2O | 4,19 | 0,74 | |
| КNO3 | 1,24 | 0,998 | |
| H2O | 4,19 | 0,001 | |
| NaCl | 0,864 | 0,001 |
В основе уравнения теплового баланса лежит закон сохранения энергии:  , где SQ,-поступающая энергия, а SQ,,-выделяющаяся энергия. В тепловом балансе учитываются:
, где SQ,-поступающая энергия, а SQ,,-выделяющаяся энергия. В тепловом балансе учитываются:
1. теплота входящих и выходящих продуктов
2. теплота за счет химических превращений
3. теплота, теряемая аппаратом в окружающую среду.
Рассмотрим процесс кристаллизации.
Найдем удельную теплоту кристаллизации по формуле.
 , где С1 и С2 – растворимости при температурах Т1 и Т2, М - молярная масса кристаллизующегося вещества. Пусть раствор поступает при температуре 80 градусов, а уходит при температуре 30о.
, где С1 и С2 – растворимости при температурах Т1 и Т2, М - молярная масса кристаллизующегося вещества. Пусть раствор поступает при температуре 80 градусов, а уходит при температуре 30о.
По графику растворимости различных солей в воде при различных температурах найдем: С(80)=17 моль безводной соли/1000г воды; С(30) 11 моль безводной соли/1000 г воды.
q=19.2*103*lg(17/11)/(101*(1/303-1/353))=3629,9/0,0505=71,88*103 Дж/кг
Количество теплоты выделяемой при кристаллизации находится по формуле:
Q=mнач. раст.*Снач.раст.*(T1-T2)+ mкрист.*q, где
Снач.раст. - удельная теплоемкость раствора поступающего на кристаллизацию, рассчитывается по формуле:
Снач.раст=∑Сi*ωi, где w- массовая концентрация вещества в растворе, а С - его теплоемкость.
Снач.раст=0,34*1,736+0,03*4,253+0,05*3,017+0,04*3,87+0,54*4,609=3,51
Q=3613,5*3,51*(80-30)*10-3+1*71,88*103=72514,2 Дж
Рассчитаем теплоты веществ расходующихся и образующихся
в ходе кристаллизации по формуле
 , где m- масса вещества, Т- температура, С - теплоемкость.
, где m- масса вещества, Т- температура, С - теплоемкость.
Qнач.раст=3.51*3,6135*80=1014,67 кДж
Найдем теплоемкость конечного продукта
Сматоч.= 2,556*0,075+1,24*0,091+4,189*0,038+2,46*0,056+4,19*0,74= 3,7 Qматоч= 3.7*2.6135*30=290.1 кДж
QKNO3=1.24*0.998*30=37.1 кДж
QNaCl=0,864*0,001*30=0,026 кДж
QН2О=4,19*0,001*30=0,1257 кДж
Потери равны 3% от DQфиз, где DQфиз= Qнач.раст - Qматоч=1014,67 - 290,1 = =724,57 кДж
Qпот=0,03*724,57=21,737 кДж
таблица теплового баланса
| Приход | Расход | ||||
| Статья прихода | количество, кДж | Статья расхода | количество, кДж | ||
| поток | компонент | поток | компонент | ||
| Начальный раствор, в том числе KNO3 HNO3 HCl NaCl H2O NaNO3 Кристал- лизация. | 1014,6 72,5 | 171,6 33,8 46,7 2,9 713,9 45,7 72,5 | Конечный продукт, в том числе KNO3 NaCl H2O Маточный раствор, в том числе HCl KNO3 HNO3 H2O NaNO3 Потери Отвод тепла | 37,3 290.1 21,7 738,1 | 37.1 0,1 0,1 14,8 8,7 12,5 243,2 10,9 21,7 738,1 |
| Итого: | 1087,2 | 1087,2 | Итого: | 1087,2 | 1087,2 |
Расходные коэффициенты
Найдем расходные коэффициенты:

Хлорид калия
β=911,5/1000=0,9115
Хлорид натрия
β=102/1000=0,1023
Азотная кислота
β=2656,25/1000=2,656
Острый пар
β=337,35/1000=0,337
Заключение
В данном курсовом проекте подробно описан технологический процесс получения нитрата калия из хлорида калия и азотной кислоты. Приведен расчет материального баланса для всего процесса и расчет теплового баланса на стадии кристаллизации. Также приведены расходные коэффициенты, их значения ниже 1 кроме коэффициента по азотной кислоте, который равен 2,6. Так как расходуется много азотной кислоты этот способ не нашел широкого распространения.
Список использованных источников:
1. Технология минеральных солей, М. Е. Позин, издательство «ХИМИЯ», 1947, два тома.
2. Процессы и аппараты химической технологии, Я. Д. Авербух, Ф. П. Заостровский, Л. Н. Матусевич, издание УПИ, 1973, два тома.
3. Примеры и задачи по курсу процессов и аппаратов химической технологии, К. Ф. Павлов, П. Г. Романков, А. А. Носков, «ХИМИЯ», 1987.
4. Полный энциклопедический справочник.- М.: Русское энциклопедическое товарищество, 2001.-928с.