 |
|
Обработка результатов измерений
Измерения
1. Включить установку тумблером «СЕТЬ». Повернуть ручку крана 3 в положение «ОТКРЫТ» 9 рис.2.Включить тумблер «КОМПРЕССОР». Накачивать воздух в баллон до красной линии на установке, при этом разность уровней жидкости в манометре должна быть не менее 20-25 см. После этого закрыть напускной клапан поворотом ручки крана 3 в положение «ЗАКРЫТ» и отключить компрессор.
2. Подождать 2-4 минуты, пока температура воздуха в баллоне не станет равна температуре окружающей среды.
3. Измерить разность уровней жидкости h1в манометре рис.1. Полученное значение h1 записать в таблицу.
4. Резко (но не сильно!) нажать и отпустить выпускной клапан 4. При этом газ адиабатически расширяется. Давление его становится равным атмосферному, а температура понижается.
5. Через 2-3 минуты уровни воды в манометре стабилизируются. Воздух в баллоне нагревается до комнатной температуры и его давление возрастает. Как только температура газа станет равной комнатной, давление примет определенное значение. После этого определить разность уровней h2 в правом и левом колене манометра. Значение h2 записать в таблицу.
6. Повторить пункты 1-6 не менее 7-10 раз. Следить за тем, чтобы начальная разность уровней в манометре была постоянной.
Обработка результатов измерений
1. По формуле (12) вычислите величину g для каждого измерения. Найдите ее среднее значение.
2. Вычислите полуширину доверительного интервала по формуле Стьюдента как для прямых измерений при доверительной вероятности р=0,95
 .
.
3. Окончательный результат представьте в стандартном виде
 , р=0,95.
, р=0,95.
4 .Определите относительную погрешность Dg /ágñ измерения γ.
5. Сравните полученное значение 
 с тем, что дает молекулярно-кинетическая теория и которое можно вычислить по формуле
с тем, что дает молекулярно-кинетическая теория и которое можно вычислить по формуле
 ,
,
где i – число степеней свободы молекулы рассматриваемого газа.
Будем считать воздух однородным двухатомным газом (содержанием других газов, в том числе и водяного пара, пренебрежем, считая его незначительным). Что показывает сравнение?
6. Рассчитайте массу воздуха М1 в баллоне в исходном состоянии 1 по формуле
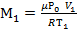 .
.
7. Рассчитайте температуру газа Т2 в баллоне к концу расширения (процесс1–2) по формуле
 ,где
,где 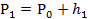
Таблица
| Давл. атмосфер. Р0 = Темпер. комн. Т1˚= Объем сосуда V=7л | ||||||
| № изм. | h1 | h2 | h1 - h2 | g | 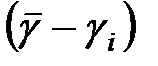
| 
|
| ||||||
| Ср. |
Контрольные вопросы
1. Запишите первое начало термодинамики. Что называется внутренней энергией.
2. Что называется теплоемкостью – удельной, молярной? Как теплоемкость различается в зависимости от процесса?
3. Почему Ср больше, чем СV и на сколько? Каков физический смысл универсальной газовой постоянной R ?
4. Какой процесс называется адиабатическим? Напишите уравнение адиабаты и сравните его с уравнением изотермы.
5. Чему равно теоретическое и табличное значение g для воздуха? Почему полученное вами значение отличается от табличного?
6 .Почему на рис.2 кривая 3-4 идет круче кривой 1-2? Почему обе кривые идут круче кривой 1-3?
7. Вывод рабочей формулы (7).
Список рекомендуемой литературы
1.Сивухин Д.В. Общий курс физики.Т 2. Термодинамика и молекулярная физика. М.: Физматлит, 2006. §21-22.
2.Савельев И.В. Курс общей физики. Т.1. Механика и молекулярная физика. СПб.: Лань, 2005.§87-88.
3.Трофимова Т.И. Курс физики. М.: Высшая школа, 1990. С.91-96.
4.Детлаф А.А., Яворский Б.М. Курс физики. М.: Высшая школа, 1989. §9.6; 10.12.