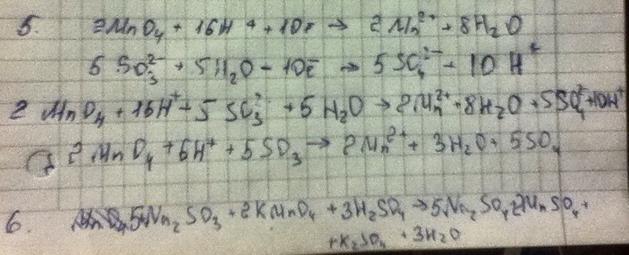|
|
Реакция второго порядка


График зависимости концентрации реагента A для второго порядка реакции
Для реакций второго порядка кинетическое уравнение имеет следующий вид:

или

В первом случае скорость реакции определяется уравнением

Линейная форма уравнения:
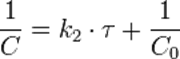
Константа скорости реакции равна тангенсу угла наклона прямой к оси времени:
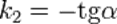

Во втором случае выражение для константы скорости реакции будет выглядеть так:
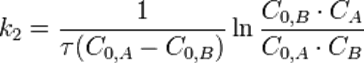
Период полупревращения (для случая равных начальных концентраций!):

Уравне́ние Арре́ниуса устанавливает зависимость константы скорости  химической реакции от температуры
химической реакции от температуры 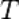 .
.
 A-const зависит от природы в-ва-частотный фактор. Е – энергия активации.
A-const зависит от природы в-ва-частотный фактор. Е – энергия активации.
Правло Ван-Гоффа
При повышении температуры на каждые 10 градусов константа скорости гомогенной
элементарной реакции увеличивается в два—четыре раза.
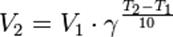
|
Правило Вант-Гоффа — эмпирическое правило, позволяющее в первом приближении оценить влияние температуры на скорость химической реакции в небольшом температурном интервале (обычно от 0 °C до 100 °C). Я. Х. Вант-Гофф на основании множества экспериментов сформулировал следующее правило:
где 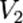 — скорость реакции при температуре
— скорость реакции при температуре  ,
, 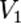 — скорость реакции при температуре
— скорость реакции при температуре  ,
, 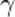 — температурный коэффициент реакции (если он равен 2, например, то скорость реакции будет увеличиваться в 2 раза при повышении температуры на 10 градусов).
— температурный коэффициент реакции (если он равен 2, например, то скорость реакции будет увеличиваться в 2 раза при повышении температуры на 10 градусов).
Энергия активации – минимальное количество энергии которое требуется сообщить системе, чтоб пошла реацкия.
В модели Теории Активных Соударений есть 3 условия:
1) молекулы должны сталкиваться
2) молекулы должны обладать необходимой Е активации для преодоления барьера
3) молекула должна быть правильно ориентирована относительно друг друга

где k — константа скорости реакции, 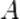 — фактор частоты для реакции,
— фактор частоты для реакции, 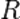 — универсальная газовая постоянная,
— универсальная газовая постоянная, 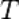 — температура в кельвинах.
— температура в кельвинах.
С повышением температуры растёт вероятность преодоления энергетического барьера.
Гомогенный и гетерогенный катализ (рассмотреть с помощью энергетических диаграмм теории активных соударений и теории активированного комплекса). Примеры катализаторов. Автокатализ. Ингибиторы (примеры). Каталитические яды.
Катализ
Катализ – явление изменения скорости реакции в присутствии веществ, состояние и количество которых после реакции остаются неизменными.

Гомогенный катализ – каталитические реакции, а которых реагенты и катализатор находятся в одной фазе.
A+B->C
A+K->AK
AK+B->C+K
CH3CHO->CH4+CO
CH3CHO+Y2->CH3Y+HY+CO
CH3Y+HY->CH4+Y2
С катализатором (У) скорость реакции возросла в 105 раз)
Гетерогенный катализ – каталитические реакции на поверхности раздела фаз, образованных катализатором и реагирующими веществами.
1)диффузия исходных в-в к поверхности катализатора
2) адсорбция исходных в-в на поверхности с образованием промежуточного состояния (A+B+K->ABK)
3) активация адсорбированного состояния (ABK->ABK*)
4) Распад активированного комплекса с образованием адсорбированных продуктов (ABK*->CDK)
5) Десорбция продуктов реакции с поверхности катализатора (CDK->C+D+K)
6) Диффузия продуктов реакции от поверхности катализатора (2H2O-MnO2>2H2O+O2)
Пример:
1)d-элементы и их оксиды.
2)серная и фосфорная кислоты
Автокатализ
Катализ химической реакции одним из ее продуктов или исходного в-ва
Пример – окисление щавелевой кислоты марганцовкой.
2MnO4+5C2O42+16H=2Mn2+10CO+8H2O
Ингибитор – вещество, замедляющее реакцию (старение полимеров, окисление топлива)
Каталитические яды – в-ва инактивируют катализаторы и превращают его в другое вещество.
Обратимые и необратимые химические реакции. Химическое равновесие с позиции термодинамики и кинетики. Константа равновесия для гомогенных и гетерогенных процессов. Принцип ре-Шателье. Влияние концентрации, давления и температуры на сдвиг равновесия (объяснить с позиции кинетики или термодинамики)
Необратимые реакции протекают до конца – до полного расхода одного из реагентов.
При обратимой реакции ни одно из реагирующих веществ не расходуется полностью.
Необратимая – Zn+4HNO3=Zn(NO3)2+2NO2+2H2O
Обратимая – N2+3H2-><-2NH3
Когда скорость прямой и обратной реакций становится одиноковой, наступает химическое равновесие.
Характеристикой равновесия служит константа равновесия.
Отношение констант скорости прямой и обратной реакций – тоже константа равновесия.
H2+Y2=2HY
K=[HY]2/[H2]*[Y2]
Общий случай: aA+bB=pP+qQ
K=[P]p[Q]q/[A]a[B]b
В гетерогенных реакциях в константу входят только жидкие и газообразные в-ва.
CO2+C=2CO
K=[CO]2/[CO2]
Принцип ре Шателье
-если на систему находящуюся в равновесии воздействуют извне, изменяя какое либо из условий равновесия (t, P, концентр) то в системе усиливаются процессы направленные на компенсацию внешнего воздействия
Влияние концентрации:
Если происходит увеличение концентрации в-в в правой части ур-я и уменьшение концентрации слева, то равновесие сдвинется вправо. Если наоборот – влево.
При уменьшении концентрации в-ва равновесие сдвигается в сторону расхода этого вещества.
Влияние давления: (путем изменения обьема)
Приувеличении давления путем сжатия систему равновесие сдвигается в сторону уменьшения числа молекул газов, т.е в сторону понижения давления. При уменьшении давления равновеисе равновесие сдвигается в сторону возрастания числа молекул газов, т.е в сторону увеличения давления.
Влияние температуры:
При повышении температуры равновесие смещается в направлении эндотермической реакции, а при понижении – в направлении экзотермической.
Растворы как разновидность дисперсных систем. Классификация дисперсных систем по степени дисперсности и по типу агрегатного состояния. Суспензии и коллоидные растворы. Гели. Строение мицеллы коллоидной частицы. Понятия абсорбция, адсорбция, десорбция. Лиофильные и лиофобные вещества.
Смеси веществ по степени дисперсности разделяют на грубодисперсные (больше 100нм), коллоидные растворы (1-100нм) и истинные растворы (размер частиц как у ионов и молекул)
Механические смеси (взвеси) и коллойдные растворы являются многофазными (гетерогенными) системами, в которых частица одного или нескольких в-в распространены в какой либо среде.
Механические смеси в зависимости от агрегатного состояния среды и распределенных в ней других в-в имеют свои особые названия.
Суспензия – взвесь чатиц одного или не одного в-ва в жидкой среде. Обычно частицы так велики, что оседают под силой тяжести. Устойчивые суспензии образуются в тех случаях, когда плотность твердой и жидкой фаз почти равна. Пример – гуашь, сок с мякотью.
Эмульсия – взвесь капель одной или нескольких жидких фаз в среде другой жидкости. Пример – молоко, латексная краска.
Аэрозоль – взвесь жидких и твёрдых частиц в газообразной среде. (туман, дым)
Пена - образуется при распределении пузырьков газа в жидкой или твердой среде (любая пена)
Коллойдные растворы (золи) – системы, включающие среду, где распределены очень маленькие частицы.
Методы получения:
1)Дисперсирование (измельчение)
2)Конденсация (укрупнение)
Гели – структурированные системы из высоко и низкомолекулярных в-в.
Св-ва: текучесть, способность сохранить прочность и способность к деформации (пластичность и упругость)
Гидрогель – водная дисперсная среда
Алкогель – спиртовая среда
Органогели – углеводородная среда
Гели термодинамически неустойчивы.
Строение мицеллы молекулы коллойдного раствора.
Ядро нейтрально, состоит из n молекул H2SO3, на поверхности ядра адсторбируются m ионов SiO3 – адсорбированные потенциалоопределяющие ионы – противоионы

Абсорбция – поглощение одного вещества всем обьемом другого.
Адсорбция – поглощение одного в-ва поверхностью другого.
Десорбция – обратный адсорбции процесс. Удаление одного в-ва с поверхности другого.
Лиофильные – притягивающие жидкость
Лиофобные – отталкивающие жидкость.
Процесс образования истинных растворов, интегральная теплота (энтальпия) растворения. Растворимость. Способы выражения концентрации (массовый и мольный проценты, молярная, моляльная и нормальная концентрации растворов). Влияние внешних факторов на растворимость твердых веществ, жидкостей, газов. Законы Генри и Генри-Дальтона. Коллигативные свойства разбавленных растворов неэлектролитов (закон Рауля и его следствия, осмотическое давление). Определение молярных масс растворенных веществ. Диаграмма состояния воды.
Истинные растворы – размер частиц 10-8 см, т.е равны размерам молекл и ионов. В таких системах гетерогенность исчезает – системы становятся гомогенными (рр сахара, рр спирта)
Интегральная теплота (энтальпия) – растворение одного моля в-ва при постоянном давлении в определенном кол-ве раствора (большом)
Растворимость – способность разных в-в растворяться в ратворителе.
Мерой растворимости в-ва при данных условиях служит содержание его р насыщенном р-ре
Способы выражения концентрации
Массовая доля — отношение массы растворённого вещества к массе раствора. Массовая доля измеряется в долях единицы или в процентах:
 ,
,
где:
m1 — масса растворённого вещества, г;
m — общая масса раствора,
Молярная доля – отношение кол-ва растворенного к сумме количеств в-в составляющих раствор. 
nb – кол-во вещества, содержащегося в раствре
сумма – сумма кол-в вещества всех компонентов р-ра
Х – мольная доля
Молярная концентрация (молярность) – отношение кол-ва вещества растворенного к обьему раствора.
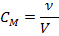
v – кол-во растворенного в-ва.
V – общий обьем раствора.
Моляльная концентрация (моляльность) – отношение кол-ва расворенного в-ва к массе растворителя. 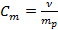
Нормальная концентрация (эквивалентная) – отношение числа эквивалентов растворенного в-ва к общему обьему р-ра. 
Влияние внешних факторов на растворимость в-в
Влияние температуры (принцип ре шателье)
В Эндотерм. процессе дельтаH>0 (твердое в-во) повышение тепературы усиливает рстворимость
В экзотерм процессе дельта H<0 повышение темературы уменьшает ратворимость.
Раствор газов при повышении температуры растворимость газов понижается.
Влияние давления на растворимость газов (закон Генри).
Зако́н Ге́нри — закон, по которому при постоянной температуре растворимость газа в данной жидкости прямо пропорциональна давлению этого газа над раствором. Закон пригоден лишь для идеальных растворов и невысоких давлений.

где:
 — парциальное давление газа над раствором,
— парциальное давление газа над раствором,
 — молярная концентрация газа в растворе,
— молярная концентрация газа в растворе,
 — коэффициент Генри.
— коэффициент Генри.
Закон Генри-Дальтона – то же самое, но для нескольких газов.
Коллигативные свойства разбавленных растворов неэлектролитов.
-не зависят от природы вещества
-зависят от концентрации
Закон Рауля:
Относительное понижение парциального давления пара растворителя над раствором не зависит от природы растворённого вещества и равно его мольной доле в растворе.
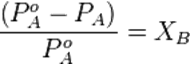
Следствие: повышение температуры кипения раствора по сравнению с температурой кипения растворителя, а равно и понижение температуры замерзания раствора по сравнению с аналогичным характеризующей величиной для растворителя прямо пропорциональна моляльности раствора, то есть,
ΔTкип/зам= Kэб/кр · mв-ва, где
Kэб/кр — соответственно эбулиоскопическая (от лат. ebullire — «кипеть» и др.-греч. σκοπέω — «наблюдаю») и криоскопическая (относится к замерзанию) константы, характерные для данного растворителя;
mв-ва — моляльность вещества в растворе
Осмотическое давление – избыточное гидростатичское давление на раствор, отделенный от чистого растворителя полупроницаемой мембраной, при котором прекращается диффузия растворителя через мембрану (осмос)
P=CRT
CMв-ва — молярная концентрация раствора, выраженная в  , а не в
, а не в  , как обычно;
, как обычно;
R — универсальная газовая постоянная;
T — термодинамическая температура системы.
Диаграмма состояния воды:
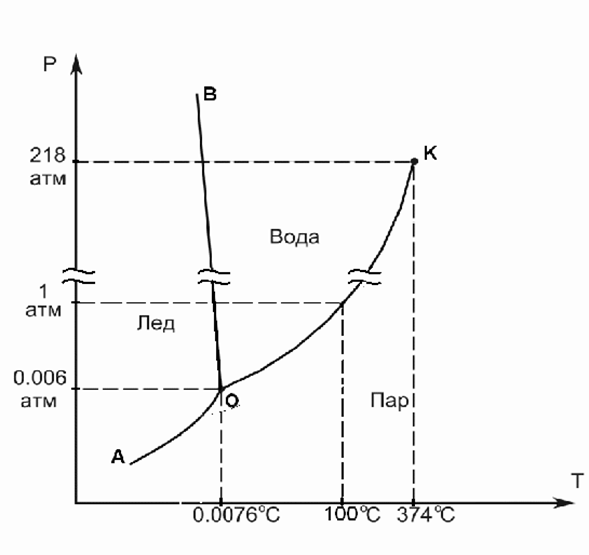
ВО – кривая кристаллизации
ОК – кривая испарения
АО – возгона (сублимации)
Особенности растворов электролитов. Теория электролитической диссоциации. Количественные характеристики процесса диссоциации (степень и константа диссоциации, изотонический коэффициент, электропроводимость). Закон разбавления Оствальда. Сильные и слабые электролиты. Особенности растворов сильных электролитов.
Для электролитов осмотическое давление и блаблабла всегда выше обусловленного концентрацией раствора.
P=iCRT i-изотонический коэффициент (во сколько раз осмотическое давление больше нормалього)
I=dTэкспериментальная/dTтеорет
d-дельта
Cоли, кислоты и основания, растворяясь в воде, создают значительно большее осмотическое давление чем эквивалентные кол-ва всех остальных веществ.
Водные растворы солей, кислот и оснований обладают еще одной особенностью – они проводят ток. В-ва проводящие ток своими ионами называются электролитами.
Число частиц в растворе увеличивается за счет распада их на ионы.
HCl=H+Cl
KCl=K+Cl
1)в растворе электролита происходит диссоциация (распад на ионы)
2)dP, Т осм, dT зависит не только от n, но и степени диссоциации молекул на ионы
степень = Nдис/N
3)степень диссоциации увеличивается с разбавлением
Характеристики диссоциации:
1)степень = Nдис/N
Сильные >0,3
Средние 0,1<степень<0,3
Слабые <0,1
2)константа дис. K 
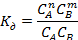

3)изотонический коэффициент i
коэффициент изотонический i (коэффициент Вант-Гоффа) – число, показывающее во сколько раз общее количество частиц в растворе больше, чем количество молекул электролита (N)
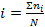 n-число ионов на которые распадается молекула
n-число ионов на которые распадается молекула
Закон разбавления Оствальда.

Сильные электролиты при растворении в воде практичски полностью диссоциируют на ионы не зависимо от их концентрации в растворе :
-растворы соли
-многие неорганические кислоты( HNO3, HCl, H2SO4, HBr, HY)
-основания, обр. щелочными металлами (LiOH, NaOH, KOH) и щелочноземельными (Ca(OH)2, Sr(OH)2, Ba(OH)2)
Слабые электролиты в водных растворах лишь частично диссоциируют на ионы.
-почти все органические кислоты и вода
-некоторые неорганические кислоты (H2S, H3PO4, H2CO3, HNO3)
-нерастворимые гидроксиды металлов (Mg(OH)2, Fe(OH)2, Zn(OH)2)
Особенность растворов сильных электролитов состоит в том, что ионы вследствии существования электростатических сил взаимодействуют между собой.
Окислительно восстановительные реакции. Типичные окислители и восстановители. Типы ОВР. Окислительно восстановительная двойственность. Влияние температуры и среды на протекание ОВР. Примеры. Расстановка коэффициентов в ОВР методами электронного и ионно-электронного баланса.
Окисли́тельно-восстанови́тельные реа́кции, также редокс (англ. redox, от reduction-oxidation — окисление-восстановление) — это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем.
В процессе окислительно-восстановительной реакции восстановитель отдаёт электроны, то есть окисляется; окислитель присоединяет электроны, то есть восстанавливается. Причём любая окислительно-восстановительная реакция представляет собой единство двух противоположных превращений — окисления и восстановления, происходящих одновременно и без отрыва одного от другого.

Типы ОВР:
1)Межмолекулярные реакци, в которых оисляющиеся и восстанавливающиеся атомы находятся в молекулах разных вществ

2)Внутримолекулярного типа – в молекулах одного вещества.
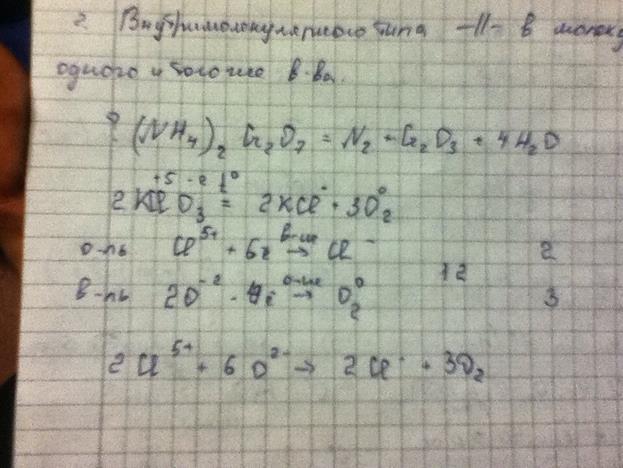
3)Диспропорционные (самоокисление и самовост.) – один и тот же элемент является окислителем и восстановителем:

4)репропорционные – из двух разных степеней окисления одного и того же элемента получается одна степень окисления:

Окислительно-восстановительная двойственность – это способность атома, находящегося в промежуточной степени окисления, быть как восстановителем, так и окислителем, в зависимости от того, с каким веществом он реагирует.
-все не металлы (кроме фтора и кислорода) (нитриты, сульфиты, некоторые сложные в-ва SO2)
Влияние температуры и среды на протекание ОВР:
Среда 
При изменении концентрации и температуры величина потенциала ОВР определяется уравнением Нернста: 
Расставление коэффициентов методом электронного баланса
1) Записать реакцию в молекулярном и ионно молекулярном виде, определить ионы и молекулы, изменяющие степень окисления.
2) Определить среду, в которой протекает реакция (H-кисл, OH – щелочь, H2O – нейтр)
3) Составить ионно молекулярное уравнение каждой полуреакциии уравнять число атомов всех элементов
1)Количество O уравнивают используя молекулы воды как ионы OH
2)если исходный ион и молекула создают большее количество атомов О, чем продукт реакции, то:
-избыток ионов О в кислой среде связывается с Н в молекле Н2О
-в нейтральной и щелочной среде избыток О связывается молекулами воды в групы ОН
3) исходный ион или молекула создает меньшее число атомов кислорода, чем продукт реакции
- недостаток компенсируется за счет молекул воды
-в щелочных растворах за счет ионов ОН
4) составить электронно-ионные уравнения
5)суммировать полученные электронно-ионные уравнения. Сократить подобные и получить ионно молекулярное уравнение ОВР
6)По полученному ионно молекулярному уравнению составить молекулярное.
Пример: