 |
|
Перечень вопросов допуска и защиты лабораторных работ по химии
(СЖД, 1 курс, 2012-2013уч.год )
| №лб | Тема | вопросы | |
| допуск | защита | ||
| Электронная структура атомов и одноатомных ионов | 1. Привести пример электронной формулы атома элемента. 2. Привести пример графической схемы атома элемента. 3. Дать название соли, раствор которой будете использовать при проведении первого опыта. 4. Привести формулы солей, растворы которых будете использовать при проведении второго опыта. 5. Устройство и принцип работы аппарата Киппа. | 1. Укажите значение главного квантового числа  , характеризующее уровень энергии электронов в атоме гелия.
2. Укажите значение спинового квантового числа двух электронов внешнего энергетического уровня в атоме магния.
3. Какие значения магнитного квантового числа , характеризующее уровень энергии электронов в атоме гелия.
2. Укажите значение спинового квантового числа двух электронов внешнего энергетического уровня в атоме магния.
3. Какие значения магнитного квантового числа  характеризую состояние р - электронов в атоме азота.
4. Атому какого химического элемента отвечает электронная конфигурация характеризую состояние р - электронов в атоме азота.
4. Атому какого химического элемента отвечает электронная конфигурация  ?
5. Электронную конфигурацию атома выражают следующей сокращенной формулой: ?
5. Электронную конфигурацию атома выражают следующей сокращенной формулой:  . Что это за элемент?
6. Напишите формулу (полную и сокращенную) электронной конфигурации атома . Что это за элемент?
6. Напишите формулу (полную и сокращенную) электронной конфигурации атома  и иона и иона 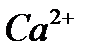 .
7. Сколько электронов на внешнем энергетическом уровне в атоме кремния? Покажите их расположение в квантовых ячейках.
8. Приведите схему распределения внешних электронов по квантовым ячейкам атома селена. .
7. Сколько электронов на внешнем энергетическом уровне в атоме кремния? Покажите их расположение в квантовых ячейках.
8. Приведите схему распределения внешних электронов по квантовым ячейкам атома селена.
| |
| Классы химических соединений | 1. Правила нагревания пробирки с помощью спиртовой горелки. 2. Что такое индикатор? 3. Правила обращения со спиртовой горелкой. 4. Написать графическую формулу серной кислоты. 5. Почему растворы щелочей нельзя хранить в стеклянной таре? | 1.Какие классы неорганических веществ существуют? 2. Какие вещества относятся к оксидам и каковы их химические свойства? 3. Какие вещества называются основаниями и каковы их химические свойства? 4. Какие соединения называются кислотами, каковы их отличительные химические свойства? 5. Какие вещества называются солями и каковы их свойства? 6. Чем отличаются по составу основные, кислые, средние соли? | |
| Скорость химических реакций и химическое равновесие | 1. Бюретка – устройство и предназначение 2. Основные этапы проведения опыта «Смещение химического равновесия» 3. Как правильно заполнить бюретку раствором? 4. Что такое мениск жидкости? Виды менисков 5. Как правильно определить объём раствора в бюретке? | 1. Чем измеряется скорость реакции и от каких факторов она зависит? 2. Каков физический смысл константы скорости? 3. Составить уравнение скорости образования воды из водорода и кислорода и показать, как изменится скорость, если концентрацию водорода увеличить в три раза? 4. Как изменяется скорость реакции с течением времени? 5. Какие реакции называются обратимыми? 6. При каких условиях наступает химическое равновесие? 7. Что такое константа равновесия? 8. Что называется смещением химического равновесия, принцип Ле-Шателье? 9. Определить исходные концентрации водорода и брома, если при равновесии реакции H2 + Br2 « 2HBr концентрации всех веществ в системе оказались следующими: 10. H2] = 0,31 моль/л, [ Br2 ] = 1,25 моль/л, [ HBr ] = 0,8 моль/л. 11. Константа равновесия системы при некоторой температуре равняется 1. Если исходные концентрации [СО] = 1; [Н2О] = 3, то каковы будут концентрации всех веществ в момент равновесия? 12. Как следует изменить (увеличить или уменьшить) температуру и концентрацию веществ в равновесной системе СО + Н2О « СО2 + Н2 + 42,63 кДж, чтобы получить возможно больше водорода? | |
| Электролиты | 1. Как меняет цвет индикатор метиловый оранжевый в зависимости от реакции среды раствора? 2. Привести примеры сильных электролитов. 3. Привести примеры слабых электролитов. 4. Какой цвет водному раствору придают ионы меди и ионы никеля? 5. Как правильно определить запах вещества? | 1. Какие вещества называются электролитами? 2. Какова сущность процесса электролитической диссоциации? 3. Как различаются сильные и слабые электролиты? 4. В чем отличие диссоциации сильных и слабых электролитов? 5. Что такое константа диссоциации слабых электролитов, и как применяется принцип Ле-Шателье к диссоциации слабых электролитов? 6. Что такое ионно-молекулярные реакции обмена в растворах электролитов и как они записываются? | |
| Определение рН. Гидролиз солей | 1. Как, пользуясь универсальной индикаторной бумагой, определить pH раствора? 2. Основные этапы проведения опыта 2.1 «Гидролиз солей» 3. Основные этапы проведения опыта 2.4 «Полный гидролиз» 4. Написать формулу основной соли нитрата дигидроксовисмута. 5. Как меняет цвет индикатор фенолфталеиновый в зависимости от реакции среды раствора? | 1. Что понимается под водородным показателем, рН? 2. Что называется гидролизом солей? 3. Какие факторы влияют на гидролиз? 4. В каких случаях при гидролизе солей получаются кислые и основные соли? 5. Какие соли не подвергаются гидролизу и почему? Объясните на конкретных примерах. 6. Какова величина рН среды (больше или меньше) при гидролизе солей, образованных сильными кислотами и слабыми основаниями, сильными основаниями и слабыми кислотами? | |
| Окислительно-восстановительные свойства азотной и азотистой кислот, их солей | 1. Написать химические формулы азотной, серной и азотистой кислот. 2. Определить степень окисления азота в азотной кислоте и сделать вывод об окислительно-восстановительных свойствах данного вещества. 3. Определить степень окисления азота в азотистой кислоте и сделать вывод об окислительно-восстановительных свойствах данного вещества. 4. Правила работы с концентрированными растворами кислот и щелочей 5. Как меняет цвет индикатор лакмус в зависимости от реакции среды раствора. | 1. Какие реакции называются окислительно-восстановительными? 2. Каков механизм действия окислителя и восстановителя? 3. Какое влияние оказывает концентрация азотной кислоты на ее окислительные свойства? 4. Как спрогнозировать окислительно-восстановительные свойства вещества (проявляет только окислительные, только восстановительные, и восстановительные, и окислительные)? 5. Как расставить коэффициенты в уравнении окислительно-восстановительной реакции с помощью метода электронного баланса? | |
| Качественный анализ катионов и анионов. | 1. Какую реакцию называют «реакцией золотого дождя», почему? 2. Написать химические формулы берлинской лазури и турнбулевой сини, обозначить заряды ионов. 3. Основные этапы проведения опыта 1.1 «взаимодействие катиона аммония со щёлочью» 4. Перечислить качественные реакции на катионы свинца (II) 5. Указать цвет комплексных ионов: [Fe(SCN)6]3- и [Co(SCN)4]2- | 1. Дать определение аналитической реакции. Привести пример. 2. Какая аналитическая реакция называется специфической? Привести пример. 3. Какая аналитическая реакция называется групповой? Привести пример. 4. Дробный и систематический методы анализа. 5. Охарактеризовать I, II, III группы катионов по кислотно-основной классификации 6. Охарактеризовать IV, V, VI группы катионов по кислотно-основной классификации 7. Аналитические группы анионов, их характеристика 8. Какой цвет придают водному раствору следующие ионы: Cr2+, Fe2+, Fe3+, Mn2+, Cu2+, Co2+, Ni2+? | |
| Электрохимические свойства металлов | 1. СЭП. Спрогнозировать активность металлов в ряду: цинк, железо, олово, медь 2. Как опытным путём установить, что цинк химически активнее свинца? 3. Привести пример электрохимической схемы гальванического элемента. 4. Основные этапы проведения опыта 2.3.2 «Защитные свойства металлических покрытий» 5. Основные этапы проведения опыта 2.4 «Электролиз» | 1. Какие известны электрохимические свойства металлов и электрохимические процессы? 2. В чем сущность явления возникновения потенциалов на границе металл - электролит? 3. Как возникает и протекает процесс электрохимической коррозии в опытах? 4. Как организуется и протекает процесс электролиза с нерастворимым и растворимым анодами? В чем отличие электролиза от коррозии? 5. В чем сущность работы химического источника тока на примере элемента Гренэ? | |
| Отношение металлов к кислотам и щелочам | 1. Перечислить продукты реакции взаимодействия концентрированной азотной кислоты и меди? 2. Перечислить продукты реакции взаимодействия разбавленной азотной кислоты и магния? 3. Основные этапы проведения опыта 5 «Действие щелочи на металлы» 4. Что такое амфотерность? | 1. Какие реакции называются окислительно-восстановительными (ОВР)? 2. В чем сущность и отличие ОВР? 3. Какие вещества называются окислителем, восстановителем? 4. Что называется степенью окисления (СО)? Каковы исходные данные для расчета СО. 5. Какова последовательность составления ОВР? 6. Какими свойствами обладают металлы, кислоты и щелочи? |
©2015 arhivinfo.ru Все права принадлежат авторам размещенных материалов.