 |
|
Глава 8. ОСНОВЫ ФИЗИКИ ТВЕРДОГО ТЕЛА
В физике под твердыми телами понимают кристаллы.
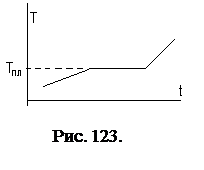 1). Характерной особенностью кристаллов является их анизотропия, т.е. зависимость физических макроскопических свойств от пространственного направления в кристалле. К таким свойствам относятся, например, упругость, сжимаемость, теплопроводность, диэлектрическая проницаемость.
1). Характерной особенностью кристаллов является их анизотропия, т.е. зависимость физических макроскопических свойств от пространственного направления в кристалле. К таким свойствам относятся, например, упругость, сжимаемость, теплопроводность, диэлектрическая проницаемость.
2). Кроме этого, кристаллическое твердое тело имеет точку плавления (кристаллизации). В отличие от аморфных тел, кристаллы в равновесном состоянии при постоянном давлении плавятся и кристаллизуются при постоянной температуре. Пример диаграммы плавления представлен на рис. 123.
 |
 3). Кристаллические тела делятся на монокристаллы и поликристаллы. Монокристаллы различных веществ имеют свою собственную структуру и огранку. Если монокристалл вырастает в равновесных условиях, он имеет форму правильных многогранников. Углы между соответствующими гранями монокристаллов одного и такого вещества постоянны (закон Стенопа) Законы геометрии кристаллов (18-19 век) привели к гипотезе о модели кристаллической решетки. На рис. 124 представлена геометрическая форма монокристалла правого
3). Кристаллические тела делятся на монокристаллы и поликристаллы. Монокристаллы различных веществ имеют свою собственную структуру и огранку. Если монокристалл вырастает в равновесных условиях, он имеет форму правильных многогранников. Углы между соответствующими гранями монокристаллов одного и такого вещества постоянны (закон Стенопа) Законы геометрии кристаллов (18-19 век) привели к гипотезе о модели кристаллической решетки. На рис. 124 представлена геометрическая форма монокристалла правого  - кварца
- кварца 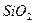 . На следующих рисунках представлены фотографии различных кристаллов.
. На следующих рисунках представлены фотографии различных кристаллов.
Синтетический кварц

Кристаллы гранатита

Друза горного хрусталя

Изумруд
Силы взаимодействия частиц и типы кристаллических решеток
1). Гетерополярная, ионная связь. Ионная связь порождается электрическими силами взаимодействия положительных и отрицательных ионов. Ионы порождаются переходом валентных (периферийных) электронов от одного атома к другому, при перекрытии их электронных оболочек. Примером может служить взаимодействие атомов натрия 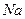 и хлора
и хлора  . У атома
. У атома 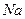 на внешней электронной оболочке находится один, слабосвязанный электрон. У атома
на внешней электронной оболочке находится один, слабосвязанный электрон. У атома  на внешней электронной оболочке находится семь электронов. При сближении этих нейтральных атомов системе энергетически выгодно, чтобы валентный электрон натрия перешел во внешнюю оболочку хлора. При таком переходе образуются два взаимодействующих иона, порождающие молекулу
на внешней электронной оболочке находится семь электронов. При сближении этих нейтральных атомов системе энергетически выгодно, чтобы валентный электрон натрия перешел во внешнюю оболочку хлора. При таком переходе образуются два взаимодействующих иона, порождающие молекулу  . Совокупность атомов натрия и хлора в твердом состоянии образуют трехмерное упорядоченное расположение ионов, называемое кристаллической решеткой. Электронные оболочки ионов приобретают другую конфигурацию, чем в молекуле
. Совокупность атомов натрия и хлора в твердом состоянии образуют трехмерное упорядоченное расположение ионов, называемое кристаллической решеткой. Электронные оболочки ионов приобретают другую конфигурацию, чем в молекуле  . Здесь каждый ион
. Здесь каждый ион  притягивает шесть ближайших ионов
притягивает шесть ближайших ионов 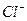 и каждый ион
и каждый ион 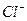 притягивает шесть ближайших ионов
притягивает шесть ближайших ионов  . Ионная связь сферически симметричная, и кристаллическая решетка
. Ионная связь сферически симметричная, и кристаллическая решетка 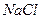 является
является  кубической (рис.125).
кубической (рис.125).
 2). Гомеополярная металлическая связь. В кристаллах металлов электроны нейтральных атомов становятся обобществленными. Получившиеся ионы образуют кристаллическую решетку, а электроны – электронный газ. Силы взаимодействия в такой решетке имеют обменный квантовый характер, и обладают сферической симметрией. Такая связь получила название металлической связи, она ненаправленная и решетка соответствует «плотной упаковки частиц». Так атомы меди отдают по два своих внешних электронов, и ионы образуют гранецентрированную кубическую решетку рис. 126.
2). Гомеополярная металлическая связь. В кристаллах металлов электроны нейтральных атомов становятся обобществленными. Получившиеся ионы образуют кристаллическую решетку, а электроны – электронный газ. Силы взаимодействия в такой решетке имеют обменный квантовый характер, и обладают сферической симметрией. Такая связь получила название металлической связи, она ненаправленная и решетка соответствует «плотной упаковки частиц». Так атомы меди отдают по два своих внешних электронов, и ионы образуют гранецентрированную кубическую решетку рис. 126.
 3). Ковалентная связь. При образовании ковалентной связи атомы «делятся» друг с другом внешними электронами. Красивым примером проявления ковалентной связи служит образование молекулы хлора
3). Ковалентная связь. При образовании ковалентной связи атомы «делятся» друг с другом внешними электронами. Красивым примером проявления ковалентной связи служит образование молекулы хлора  . Нейтральный атом хлора на внешней оболочке имеет семь электронов и он может «принять» еще один. Когда два атома хлора могут оказаться на коротком расстоянии друг от друга, их электронные оболочки частично перекроются, произойдет изменение конфигурации обеих оболочек. Появляется такая конфигурация, при которой возрастает вероятность одновременного присутствия двух электронов в области перекрытия оболочек. В рамках квантовой механики это порождает силу связи между атомами, называемую ковалентной связью. Такая связь является локализованной в определенном направлении по отношению к атомам и считается направленной связью. Для ковалентной связи, символически, принято пару «поделенных» электронов изображают одной чертой. Так для молекулы хлора имеем
. Нейтральный атом хлора на внешней оболочке имеет семь электронов и он может «принять» еще один. Когда два атома хлора могут оказаться на коротком расстоянии друг от друга, их электронные оболочки частично перекроются, произойдет изменение конфигурации обеих оболочек. Появляется такая конфигурация, при которой возрастает вероятность одновременного присутствия двух электронов в области перекрытия оболочек. В рамках квантовой механики это порождает силу связи между атомами, называемую ковалентной связью. Такая связь является локализованной в определенном направлении по отношению к атомам и считается направленной связью. Для ковалентной связи, символически, принято пару «поделенных» электронов изображают одной чертой. Так для молекулы хлора имеем 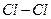 . Ковалентные связи являются очень важными в соединениях углерода. Имея четыре валентных электрона, атом углерода может образовывать четыре ковалентные связи. Они проявляются в молекуле углекислого газа, делая ее линейным образованием
. Ковалентные связи являются очень важными в соединениях углерода. Имея четыре валентных электрона, атом углерода может образовывать четыре ковалентные связи. Они проявляются в молекуле углекислого газа, делая ее линейным образованием  . Ковалентные связи позволяют углероду в монокристалле реализовать два типа кристаллической решетки, решетку алмаза и решетку графита. Вид этих решеток представлен на рис.127. На рисунке а) представлена схема решетки алмаза. Она принадлежит к макромолекулярной структуре, которую следует считать единой гигантской молекулой с чистыми ковалентными связями. Эта структура чрезвычайно прочная, обладает высочайшей твердостью, вплоть до температуры
. Ковалентные связи позволяют углероду в монокристалле реализовать два типа кристаллической решетки, решетку алмаза и решетку графита. Вид этих решеток представлен на рис.127. На рисунке а) представлена схема решетки алмаза. Она принадлежит к макромолекулярной структуре, которую следует считать единой гигантской молекулой с чистыми ковалентными связями. Эта структура чрезвычайно прочная, обладает высочайшей твердостью, вплоть до температуры 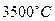 , при которой алмаз возгоняется без плавления. Подобной же макроструктурой обладает и известный кристалл кварца
, при которой алмаз возгоняется без плавления. Подобной же макроструктурой обладает и известный кристалл кварца  . На рисунке б) представлена схема решетки графита. Она относится к слоистым структурам. В каждом слое атомы углерода связаны ковалентными связями. Между слоями проявляются слабые силы Ван-дер-Ваальса.
. На рисунке б) представлена схема решетки графита. Она относится к слоистым структурам. В каждом слое атомы углерода связаны ковалентными связями. Между слоями проявляются слабые силы Ван-дер-Ваальса.
Слабые молекулярные силы Ван-дер-Ваальса. Существует несколько видов сил, близкой природы, которые относят к силам Ван-дер-Ваальса. Эти силы проявляются в молекулярных кристаллах. Примером таких кристаллов могут служить кристаллы йода  и углекислого газа
и углекислого газа  Молекулы этих веществ связаны сильными ковалентными связями, а в образовании кристаллов проявляются силы Ван-дер-Ваальса. Данные кристаллы имеют гранецентрированную кубическую решетку рис. 128. Слабые молекулярные силы Ван-дер-Ваальса позволяют этим кристаллам при атмосферном давлении и комнатных температурах возгоняться (переходить в пар), минуя жидкое состояние.
Молекулы этих веществ связаны сильными ковалентными связями, а в образовании кристаллов проявляются силы Ван-дер-Ваальса. Данные кристаллы имеют гранецентрированную кубическую решетку рис. 128. Слабые молекулярные силы Ван-дер-Ваальса позволяют этим кристаллам при атмосферном давлении и комнатных температурах возгоняться (переходить в пар), минуя жидкое состояние.
Некоторые характеристики решетки
 А). Координаты узлов решетки. В трехмерной решетке всегда можно выбрать удобный базис с векторами
А). Координаты узлов решетки. В трехмерной решетке всегда можно выбрать удобный базис с векторами  , модули их, соответственно, равны
, модули их, соответственно, равны  - расстояниям между соседними атомами базисной прямой (рис .129).
- расстояниям между соседними атомами базисной прямой (рис .129).
В этом базисе вектор положения  любого узла будет определяться соотношением:
любого узла будет определяться соотношением:
 . (8.1)
. (8.1)
Б). Система параллельных узловых плоскостей. Пусть выбрана узловая плоскость, отсекающая на координатных прямых отрезки  , тогда уравнение этой плоскости будет иметь вид:
, тогда уравнение этой плоскости будет иметь вид:
 , (8.2)
, (8.2)
где по смыслу  - отрезок координатной оси при пересечении её с заданной плоскостью, выраженный в длинах базисных векторов. Это уравнение удобно привести к виду:
- отрезок координатной оси при пересечении её с заданной плоскостью, выраженный в длинах базисных векторов. Это уравнение удобно привести к виду:
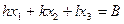 . (8.3)
. (8.3)
Целые числа  не имеют общего делителя, и носят название индексов Миллера. В геометрическом отношении, их можно определить как числа равных частей, на которые делятся отрезки
не имеют общего делителя, и носят название индексов Миллера. В геометрическом отношении, их можно определить как числа равных частей, на которые делятся отрезки  . Плоскости, с найденными индексами Миллера, параллельны между собой и имеют одинаковую плотность частиц. Символ этих плоскостей имеет вид
. Плоскости, с найденными индексами Миллера, параллельны между собой и имеют одинаковую плотность частиц. Символ этих плоскостей имеет вид  . Перпендикуляр к этим плоскостям символически обозначают квадратными скобками
. Перпендикуляр к этим плоскостям символически обозначают квадратными скобками  . Приведем пример нахождения индексов Миллера.
. Приведем пример нахождения индексов Миллера.
Пусть плоскость отсекает на координатных осях отрезки:  . Тогда уравнение плоскости запишется в виде:
. Тогда уравнение плоскости запишется в виде:
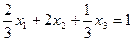 .
.
Приведя коэффициенты к общему знаменателю, получим:
 .
.
Такие параллельные друг к другу плоскости имеют индексы Миллера 2,6,1 и обозначаются как (2,6,1). В рамках «отрезков» эта, ближайшая к нулю плоскость пересечет ось 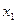 отрезком
отрезком  , ось
, ось  отрезком
отрезком  , ось
, ось  отрезком
отрезком  .
.
 Несовершенство решеток (дефекты, дислокации)
Несовершенство решеток (дефекты, дислокации)
К простым дефектам решетки следует отнести чужеродные атомы и вакансии рис. 130.
 К более сложным нарушениям совершенства решетки относятся дислокации. Среди них различают линейные дислокации и винтовые. Схемы их представлены на рис.131: а) – линейная дислокация, б) – винтовая дислокация.
К более сложным нарушениям совершенства решетки относятся дислокации. Среди них различают линейные дислокации и винтовые. Схемы их представлены на рис.131: а) – линейная дислокация, б) – винтовая дислокация.
Упругие свойства кристаллов, механизмы деформации
Характерной особенностью сил взаимодействия атомов является их «короткодействие». Частицы взаимодействуют, в основном, лишь с ближайшими соседями. Атомы в кристаллах не обладают подвижностью, как в жидкости, они «закреплены» в положениях равновесия. Даже при малых деформациях возникают значительные внутренние силы – силы упругости. Например, при продольной деформации стержня величина силы упругости пропорциональна площади поперечного сечения, поскольку она определяется числом частиц, лежащих в плоскости сечения. Отсюда, ясно, почему за силовую характеристику деформации принимают упругое напряжение – силу, отнесенную к единице площади  . Совершенные монокристаллы обладают огромной упругостью и прочностью. Наличие дефектов и дислокаций значительно ухудшают эти свойства, появляются эффекты ползучести и неупругой деформации.
. Совершенные монокристаллы обладают огромной упругостью и прочностью. Наличие дефектов и дислокаций значительно ухудшают эти свойства, появляются эффекты ползучести и неупругой деформации.
Тепловые свойства кристаллов
Если предположить, что в кристалле отсутствует тепловое движение частиц, то мы наблюдали бы строгую пространственную упорядоченность расположения неподвижных частиц в пространстве. Тепловое движение нарушает эту простую картину. Каждый атом совершает сложные негармонические трехмерные колебания, относящиеся к классу связанных колебаний. «Связанность» распространяется на все атомы кристалла.
Классические представления о внутренней энергии и теплоемкости кристаллов
 Согласно этим представлениям, каждый атом совершает трехмерное гармоническое колебание, что может быть представлено совокупностью трех одномерных осцилляторов. Кристалл, как бы, моделируется совокупностью массовых частиц и упругих пружинок (рис. 132).
Согласно этим представлениям, каждый атом совершает трехмерное гармоническое колебание, что может быть представлено совокупностью трех одномерных осцилляторов. Кристалл, как бы, моделируется совокупностью массовых частиц и упругих пружинок (рис. 132).
Итак, для  атомов в кристалле имеем
атомов в кристалле имеем  одномерных гармонических осцилляторов. Будем считать, что осцилляторы независимы друг от друга, и имеют одинаковую частоту колебаний. По классической теории средняя колебательная энергия одного осциллятора
одномерных гармонических осцилляторов. Будем считать, что осцилляторы независимы друг от друга, и имеют одинаковую частоту колебаний. По классической теории средняя колебательная энергия одного осциллятора  , где
, где  - постоянная Больцмана. Откуда, внутренняя колебательная (кинетическая) энергия кристалла из
- постоянная Больцмана. Откуда, внутренняя колебательная (кинетическая) энергия кристалла из  частиц будет равна:
частиц будет равна:
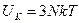 . (8.4)
. (8.4)
Полная внутренняя энергия кристалла включает в себя потенциальную энергию взаимодействия частиц, так что:
 . (8.5)
. (8.5)
Для моля  , можно записать соотношение:
, можно записать соотношение:
 . (8.6)
. (8.6)
Отметим, что рассматриваемые кристаллы не обладают электропроводностью, т.е. не содержат свободных электронов – электронного газа, энергию которого нужно было бы учитывать.
Теплоемкость кристаллов
Из полученного соотношения для внутренней энергии определим теплоемкость при постоянном объёме  .Поскольку
.Поскольку  , получим:
, получим:
 . (8.7)
. (8.7)
Это соотношение точно соответствует экспериментально установленному закону Дюлонга и Пти. Согласно этому закону мольная теплоемкость элементов в кристаллическом состоянии близка к  .
.
Отклонение от закона Дюлонга и Пти
Отклонение от закона Дюлонга и Пти экспериментально наблюдается при низких температурах. Характерная зависимость теплоемкости от температуры приведена на рис. 133.
 Квантовые представления
Квантовые представления
Для объяснения отклонения от закона Дюлонга и Пти были использованы Эйнштейном квантовые представления (1907 г.). Элементы квантовых представлений Эйнштейна для осциллятора мы рассматривали в разделе, посвященном энергии колебательных степеней свободы молекул. Там же приводилось соотношение для средней энергии квантового осциллятора. Оно имеет вид:
 .
.
Согласно представлениям Эйнштейна, кристалл из  атомов является совокупностью
атомов является совокупностью  независимых квантовых осцилляторов, обладающих одинаковой частотой
независимых квантовых осцилляторов, обладающих одинаковой частотой  . Отсюда следует соотношение для колебательной энергии в виде:
. Отсюда следует соотношение для колебательной энергии в виде:
 . (8.8)
. (8.8)
Поскольку  , получим:
, получим:
 . (8.9)
. (8.9)
Это соотношение дает зависимость теплоемкости от температуры, показывает отклонение от закона Дюлонга и Пти. Определяет правильные предельные значения теплоемкости: при  ,
,  ; при
; при  ,
,  . Это, действительно так.
. Это, действительно так.
1). Пусть  , тогда
, тогда  ,
,  и экспоненту можно разложить в ряд, представив в виде
и экспоненту можно разложить в ряд, представив в виде  . С учетом этого, можно записать:
. С учетом этого, можно записать:
 .
.
2).  , тогда в скобках знаменателя единицей можно пренебречь, и мы получим:
, тогда в скобках знаменателя единицей можно пренебречь, и мы получим:
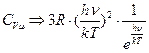 .
.
Соотношение свелось к виду:  , что соответствует неопределенности вида
, что соответствует неопределенности вида  . Для раскрытия этой неопределенности дважды воспользуемся правилом Лапиталя, и получим, что
. Для раскрытия этой неопределенности дважды воспользуемся правилом Лапиталя, и получим, что 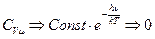 .
.
Важные отклонения от экспериментальных данных при низких температурах. Теория Дебая
Систематические измерения теплоемкости кристаллов в области низких температур показали, что теплоемкость, действительно, стремится к нулю, но не как  , а как
, а как  .
.
Дебаем (1912 г.) были введены новые представления о тепловых колебаниях атомов кристаллов. Колебания атомов принимаются не как колебания изолированных осцилляторов, имеющих одинаковую частоту по Эйнштейну, а как колебания сильно связанных осцилляторов. Связанные осцилляторы моделировались набором гармонических осцилляторов с широким, почти сплошным, спектром частот. Эта система представима набором стоячих акустических волн в кристалле, как в ограниченном твердом теле. Здесь возможны поперечные и продольные волны с минимальной длиной волны, близкой к расстоянию между соседними атомами.
Дебаем было показано, что число стоячих волн в единице объёма кристалла с частотами от значений  до значений
до значений  определяется соотношением:
определяется соотношением:
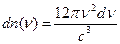 , (8.10)
, (8.10)
где  - скорость акустической волны в теле. Кроме этого, для средней энергии каждой стоячей волны было принято значение средней энергии квантового осциллятора
- скорость акустической волны в теле. Кроме этого, для средней энергии каждой стоячей волны было принято значение средней энергии квантового осциллятора  . Отсюда, энергия колебаний атомов в кристалле будет равна:
. Отсюда, энергия колебаний атомов в кристалле будет равна:
 . (8.11)
. (8.11)
Эта теория Дебая привела к полному согласию с экспериментальными данными о температурной зависимости теплоемкости кристаллов. Более подробное рассмотрение теории Дебая Вы будете рассматривать в курсе теоретической физики.
Кристаллизации, плавление, возгонка
Под кристаллизацией понимают процесс образование кристалла при построении его кристаллической решетки из окружающей среды тех же частиц. Окружающей средой может быть жидкость, пар, поликристалл того же вещества. Плавление кристалла – это образование жидкой фазы из кристалла. Под возгонкой понимают превращение кристалла в пар, минуя жидкое состояние. Эти процессы, точнее, фазовые переходы, относятся к фазовым переходам первого рода и для них справедливо выполнение уравнение Клапейрона – Клаузиуса. Этот вопрос рассмотрим несколько позднее, а сейчас коснемся зарождения и рост кристаллов. Для начала роста кристалла необходимо существование зародыша, который может самопроизвольно образоваться из переохлажденной жидкости, пересыщенного пара или пересыщенного раствора. Для целенаправленного выращивания кристалла обычно используют затравку (маленький участок монокристалла этого вещества). Малые зародыши неустойчивы и исчезают. Если зародыш достигает критических размеров, он способен расти и строить решетку. Строительство решетки так же имеет ряд особенностей и некоторые «трудности». Например, «трудности» возникают при построении новой плоскости на базе старой, но «гладкой». Если на плоскости закрепился новый атом, то при столкновении с ним другого, налетающего атома, старый может покинуть плоскость по законам механики (рис.134). Вероятность закрепления нового атома на плоскости возрастает при наличии дефектов кристалла. На рис. 134 показаны механизм роста плоскости при «ис  пользовании» винтовой дислокации.
пользовании» винтовой дислокации.
Скрытая теплота плавления и сублимации кристаллов
Кристалл, при определенном давлении и температуре, может находиться в равновесии со своей жидкостью. При подводе к этой равновесной системе, при постоянном давлении, теплоту извне, кристалл будет плавиться (переходить в жидкую фазу). Температура будет оставаться постоянной. Для поддержания постоянного давления объём необходимо изменять, если он замкнут. Подводимая теплота носит название скрытой теплотой плавления 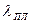 . Как и при фазовом переходе «жидкость – насыщенный пар», выделяют внутреннюю и внешнюю теплоту перехода. Кристалл может иметь переход «кристалл – насыщенный пар». Этот переход носит название сублимации, является переходом первого рода и его характеризует теплота сублимации
. Как и при фазовом переходе «жидкость – насыщенный пар», выделяют внутреннюю и внешнюю теплоту перехода. Кристалл может иметь переход «кристалл – насыщенный пар». Этот переход носит название сублимации, является переходом первого рода и его характеризует теплота сублимации 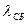 . Из закона сохранения энергии следует, что
. Из закона сохранения энергии следует, что
 . (8.12)
. (8.12)
 Уравнение Клапейрона – Клаузиуса. Фазовая диаграмма
Уравнение Клапейрона – Клаузиуса. Фазовая диаграмма
Для перехода «кристалл – жидкость» уравнение имеет вид:
 ,
,
а для перехода «кристалл – пар»  .
.
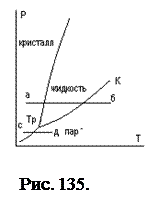
Эти уравнения позволяют обосновать фазовую  диаграмму (рис. 135).
диаграмму (рис. 135).
 Диаграмма имеет три ветви. Правая ветвь, разделяющая область жидкой фазы и пара, начинается в тройной точке
Диаграмма имеет три ветви. Правая ветвь, разделяющая область жидкой фазы и пара, начинается в тройной точке  и заканчивается в критической точке
и заканчивается в критической точке  . Эта кривая соответствует фазовому равновесию «жидкость – насыщенный пар». В замкнутом объёме жидкость находится под давлением своего насыщенного пара. Левая ветвь диаграммы разделяет жидкую фазу и кристаллическое состояние и соответствует фазовому равновесию «жидкость – кристалл». Кривая имеет две особенности: она начинается в тройной точке и неограниченна «сверху». Кроме этого, для кривой возможны неравенства:
. Эта кривая соответствует фазовому равновесию «жидкость – насыщенный пар». В замкнутом объёме жидкость находится под давлением своего насыщенного пара. Левая ветвь диаграммы разделяет жидкую фазу и кристаллическое состояние и соответствует фазовому равновесию «жидкость – кристалл». Кривая имеет две особенности: она начинается в тройной точке и неограниченна «сверху». Кроме этого, для кривой возможны неравенства:  и
и 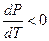 . Для первого случая удельный объем жидкости больше удельного объёма твердого тела, для второго - удельный объем жидкости меньше удельного объёма твердого тела (это ограниченный класс сред, например, вода, висмут, сурьма, чугун). Нижняя ветвь диаграммы соответствует фазовому равновесию твердое тело – насыщенный пар. Эта кривая ограничена сверху тройной точкой. Тройная точка
. Для первого случая удельный объем жидкости больше удельного объёма твердого тела, для второго - удельный объем жидкости меньше удельного объёма твердого тела (это ограниченный класс сред, например, вода, висмут, сурьма, чугун). Нижняя ветвь диаграммы соответствует фазовому равновесию твердое тело – насыщенный пар. Эта кривая ограничена сверху тройной точкой. Тройная точка  соответствует фазовому равновесию всех трех фаз. Это состояние может быть реализовано в замкнутом объёме, заполненном одним веществом. Например, для воды в этой точке давление соответствует
соответствует фазовому равновесию всех трех фаз. Это состояние может быть реализовано в замкнутом объёме, заполненном одним веществом. Например, для воды в этой точке давление соответствует 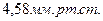 и температура равна
и температура равна  . Для более глубокого понимания фазовой диаграммы состояний, удобно рассмотреть процесс перехода из «а» в «б» Рис.135. Пусть в цилиндре под поршнем находится кристалл, соответствующий состоянию «а». Переход в состояние «б» соответствует изобарическому процессу. Кристалл нагревается, меняется его температура и для поддержания постоянного давления необходимо увеличивать объём. При пересечении прямой (а-б) с левой ветвью диаграммы, происходит плавление кристалла. Подаваемое тепло расходуется на плавление, температура остается постоянной, а объём необходимо увеличивать. После окончания плавления при продолжении подачи тепла, температура возрастает, и объём необходимо увеличивать, чтобы поддерживалось постоянным давление. При пересечении прямой «а-б» с правой ветвью диаграммы, происходит кипение жидкости. Подаваемое тепло расходуется на преобразование жидкости в пар, температура остается постоянной, а объём необходимо значительно увеличивать. При дальнейшем процессе нагревается пар, который уже не является насыщенным. Переход по изобаре «с-д» происходит аналогично рассмотренному, но в точке пересечения прямой «с-д» с нижней ветвью диаграммы, происходит возгонка кристалла, т.е. превращение его в пар. Чтобы включить в диаграмму явное изменение объёма, удобно использовать трехмерное представление в переменных
. Для более глубокого понимания фазовой диаграммы состояний, удобно рассмотреть процесс перехода из «а» в «б» Рис.135. Пусть в цилиндре под поршнем находится кристалл, соответствующий состоянию «а». Переход в состояние «б» соответствует изобарическому процессу. Кристалл нагревается, меняется его температура и для поддержания постоянного давления необходимо увеличивать объём. При пересечении прямой (а-б) с левой ветвью диаграммы, происходит плавление кристалла. Подаваемое тепло расходуется на плавление, температура остается постоянной, а объём необходимо увеличивать. После окончания плавления при продолжении подачи тепла, температура возрастает, и объём необходимо увеличивать, чтобы поддерживалось постоянным давление. При пересечении прямой «а-б» с правой ветвью диаграммы, происходит кипение жидкости. Подаваемое тепло расходуется на преобразование жидкости в пар, температура остается постоянной, а объём необходимо значительно увеличивать. При дальнейшем процессе нагревается пар, который уже не является насыщенным. Переход по изобаре «с-д» происходит аналогично рассмотренному, но в точке пересечения прямой «с-д» с нижней ветвью диаграммы, происходит возгонка кристалла, т.е. превращение его в пар. Чтобы включить в диаграмму явное изменение объёма, удобно использовать трехмерное представление в переменных  . Такая трехмерная фазовая диаграмма, для случая
. Такая трехмерная фазовая диаграмма, для случая  , представлена на рис. 136.
, представлена на рис. 136.
На этой диаграмме следующие обозначения: область К – кристалл; область К-Ж – двухфазная система кристалл – жидкость; область Ж – жидкость и газ; область Ж-П – двухфазная система жидкость – насыщенный пар; область К-П – двухфазная система кристалл – насыщенный пар. В качестве интересного замечания отметим следующие возможные состояния системы (рис. 137).
 Состояние
Состояние  получено в объёме, где, кроме жидкости и пара, находится еще и газ (например, воздух). Этот газ создает для жидкости добавочное давление при температуре
получено в объёме, где, кроме жидкости и пара, находится еще и газ (например, воздух). Этот газ создает для жидкости добавочное давление при температуре  . Давление пара будет отличаться от давления насыщенного пара при температуре
. Давление пара будет отличаться от давления насыщенного пара при температуре  , оно будет несколько выше этого давления. Состояние
, оно будет несколько выше этого давления. Состояние  можно реализовать подобным же образом. В этом состоянии кристалл находится под давлением постороннего газа, кроме давления своего пара (температура
можно реализовать подобным же образом. В этом состоянии кристалл находится под давлением постороннего газа, кроме давления своего пара (температура  выбрана ниже температуры тройной точки). Давление пара в этом случае так же будет отличаться от давления насыщенного пара на кривой равновесия кристалл – пар при температуре
выбрана ниже температуры тройной точки). Давление пара в этом случае так же будет отличаться от давления насыщенного пара на кривой равновесия кристалл – пар при температуре  (будет его несколько превышать).
(будет его несколько превышать).