 |
|
Основные законы и формулы
Министерство образования и науки Украины
Донецкий национальный технический университет
Методические указания
и контрольные задания по общему курсу физики
(раздел ,,Молекулярная физика и термодинамика ”)
для студентов-заочников
.
Рассмотрено на заседании кафедры физики
Протокол №9 от 05.05.2008 г.
Утверждено
учебно- издательским советом ДонНТУ.
Протокол №4 от 19.05.2008г.
.
Методические указания к решению задач и выполнению контрольных работ.
1. Контрольные работы нужно выполнять чернилами в школьной тетради
(для каждой контрольной работы отдельная тетрадь) и подписывать по следующему образцу :
Контрольная работа №……..
По физике
студента группы ………..
Заочного факультета ДонНТУ
Ф.И.О.
Шифр (№ зачетной книжки)
2. В каждую контрольную работу вкладывается лист для рецензента следующего образца:
Рецензия
На контрольную работу №………
По физике
студента группы…….
Заочного факультета ДонНТУ
Шифр (№ зачетной книжки)
3. Условие задач в контрольной работе надо переписывать без сокращений. Для замечаний преподавателя после решения каждой задачи оставлять страницу.
4. Если контрольная работа при рецензировании не зачтена, студент обязан представить её на повторную рецензию, включив в неё те задачи, решение которых НЕВЕРНО. Повторную работу необходимо представить вместе с незачтенной.
5. Зачтенные контрольные работы и рецензии к ним хранятся в архиве кафедры и студентам не возвращаются. Студент должен быть готов во время экзамена или зачета дать пояснения по существу решения задач, входящих в контрольную работу.
6. Решая задачи, целесообразно использовать следующие методические указания:
6.1. Прочитав условие задачи, сделать краткую запись условия, выразить все данные в единицах СИ и, где это только возможно, дать схематический чертеж, поясняющий содержание задачи.
6.2. Решение задач следует сопровождать краткими, но исчерпывающими пояснениями.
6.3. Решать задачу нужно в общем виде, т.е. выразить искомую величину в буквенных обозначениях величин, заданных в условии задачи. При таком способе решения не производятся вычисления промежуточных величин.
6.4. Вычисления по расчетной формуле нужно проводить в единицах СИ и с соблюдением правил приближенных вычислений.
6.5. В конце контрольной работы указать, каким учебником или учебным пособием студент пользовался при изучении физики (название учебника, автор, год издания). Это делается для того, чтобы при необходимости рецензент мог указать, что следует студенту изучить для завершения контрольной работы.
РАБОЧАЯ ПРОГРАММА
курса общей физики по разделу
“Молекулярная физика и термодинамика”
1. Физические основы молекулярно-кинетической теории
Молекулярно-кинетический и термодинамический методы изучения макроскопических систем. Идеальный газ. Основное уравнение молекулярно-кинетической теории. Молекулярно-кинетическое толкование температуры. Уравнение состояния идеального газа. Газовые законы как следствие Молекулярно-кинетической теории. Распределение Максвелла. Скорости газовых молекул. Опыт Штерна. Идеальный газ в поле тяготения. Барометрическая формула. Распределение Больцмана.
2. Физические основы термодинамики
Термодинамическая система. Работа и теплота как форма обмена энергией между системами. Внутренняя энергия идеального газа. Распределение энергии по степеням свободы.
Первое начало термодинамики. Применение первого начала термодинамики к анализу обратимых процессов в газах.
Теплоемкость идеального газа при различных изопроцессах.
Второе начало термодинамики. Макро- и микросостояния. Энтропия и ее статисти-ческий смысл. Неравенство Клаузиуса для цикла и процесса. Теорема Карно. КПД идеальной тепловой машины.
З. Явления переноса
Эффективный диаметр, число столкновений и средняя длина свободного пробега моле-кул.
Явления переноса в газах. Уравнения переноса. Молекулярно-кинетическая трактовка явлений переноса. Коэффициенты переноса и их анализ.
4.Реальные газы
Уравнение состояния реального газа (уравнение Ван-дер-Ваальса). Критическое состояние. Внутренняя энергия.
2.1. Молекулярно-кинетическая теория идеальных газов
Основные законы и формулы
Закон Бойля—Мариотта
РV = соnst при Т = соnst, m = соnst,
где P — давление; V — объем; Т — термодинамическая температура; m — масса газа.
Закон Гей-Люссака
V=V0(1+ 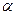 t)
t)  или
или 
при P =соnst, m = соnst;
 или
или 
при V = соnst, m = соnst,
где t— температура по шкале.Цельсия; V0 и Р0 — соответственно объем и давление при 0°С; коэффициент 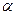 = 1/273 К -1 ; индексы 1 и 2 относятся к произвольным состояниям.
= 1/273 К -1 ; индексы 1 и 2 относятся к произвольным состояниям.
Закон Дальтона для давления смеси n идеальных, газов
 ,
,
где Рi - парциальное давление i-го компонента смеси.
Уравнение состояния идеального газа (уравнение Менделеева- Клапейрона)
РV m = RТ (для одного моля газа),
РV =  RТ (для произвольной массы газа),
RТ (для произвольной массы газа),
где Vm — молярный объем; R- газовая постоянная; М — молярная масса газа; m — масса газа;
 =
=  -количество вещества.
-количество вещества.
Зависимость давления газа от концентрации n молекул и температуры
Р = n k Т,
где k — постоянная Больцмана (k=  , NA — постоянная Авогадро).
, NA — постоянная Авогадро).
Основное уравнение молекулярно-.кинетической теории идеальных газов
Р = 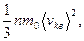
или
РV= 
или
РV= 
где  - средняя квадратичная скорость молекул; Е — суммарная кинетическая энергия поступательного движения всех молекул газа; n- концентрация молекул; m 0 — масса одной молекулы; m = Nm 0 — масса газа; N — число молекул в объёме газа V.
- средняя квадратичная скорость молекул; Е — суммарная кинетическая энергия поступательного движения всех молекул газа; n- концентрация молекул; m 0 — масса одной молекулы; m = Nm 0 — масса газа; N — число молекул в объёме газа V.
Скорость молекул:
наиболее вероятная
 ;
;
средняя квадратичная
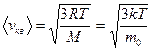 ;
;
средняя арифметическая
 ,
,
где m 0 –масса одной молекулы.
Средняя кинетическая энергия поступательного движения молекулы идеального газа
<ε> =  k T.
k T.
Закон Максвелла для распределения молекул идеального газа по скоростям
 ,
,
где функция f(v) распределения молекул по скоростям определяет относительное число молекул dN(v)/N из общего числа N молекул, скорости которых лежат в интервале от v до v + dv.
Закон Максвелла для распределения молекул идеального газа по энергиям теплового движения
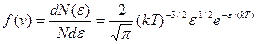 ,
,
где функция f(ε) распределения молекул по энергиям теплового движения определяет относительное число молекул dN(ε )/N из общего числа N молекул, которые имеют кинетические энергии ε = m0 v 2 /2, заключенные в интервале от ε до ε + dε .
Барометрическая формула
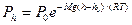
где рh, и р 0 — давления газа соответственно на высоте h и h0.
Распределение Больцмана во внёшнем потенциальном поле
n = n0 е –Mgh/(RT) или n = n 0 е –П/(kT),
гдё n и n 0 — концентрации молекул соответственно на высоте h и h0 = 0 ; П = m 0 g h— потенциальная энергия молекулы в поле тяготения.
Среднее число соударений, испытываемых молекулой газа за 1 с,
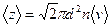 ,
,
где d — эффективный диаметр молекулы; n — концентрация молекул;  — средняя арифметическая скорость молекул.
— средняя арифметическая скорость молекул.
Средняя длина свободного пробега молекул газа

Закон теплопроводности Фурьё
 ,
,
где  Q— теплота, прошедшая посредством теплопроводности через площадь S за время t ;
Q— теплота, прошедшая посредством теплопроводности через площадь S за время t ;
 _ градиент температуры; К — коэффициент теплопроводности:
_ градиент температуры; К — коэффициент теплопроводности:
 ,
,
где cv, — удёльная теплоемкость газа при постоянном объеме; р — плотность газа;  — средняя арифметическая скорость теплового движения его молекул;
— средняя арифметическая скорость теплового движения его молекул; 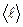 — средняя длина свободного пробега молекул.
— средняя длина свободного пробега молекул.
Закон диффузии Фика
d 
где dМ_масса вещества , переносимая посредством диффузии через площадь S за время dt;
 -градиент плотности, D-коэффициент диффузии .
-градиент плотности, D-коэффициент диффузии .
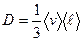
Закон Ньютона для внутреннего трения (вязкости)
 ,
,
где dp— импульс ,переносимый за время dt через площадку d  ,расположенную перпендикулярно направлению переноса импульса ;
,расположенную перпендикулярно направлению переноса импульса ;
 - градиент скорости;
- градиент скорости;
 —коэффициент внутреннего трения (динамическая вязкость).
—коэффициент внутреннего трения (динамическая вязкость).
