 |
|
Порядок виконання роботи
Теорія методу та опис приладів
Відношення питомих теплоємностей молярних газів відіграє важливу роль в адіабатичних процесах. Як відомо, метод Клемана-Дезорма грунтується на адіабатичному розширенні газів (в нашому випадку повітря).
Якщо балон, наповнений повітрям, при атмосферному тиску нагнітати додаткове повітря, то маса повітря, що була раніше в балоні, стиснеться до тиску  і займе об’єм
і займе об’єм 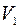 . Одночасно при цьому стиснена маса повітря нагрівається. Коли припинивши нагрівання залишити балон на 2-3 хвилини, температура повітря в балоні зрівняється з кімнатною
. Одночасно при цьому стиснена маса повітря нагрівається. Коли припинивши нагрівання залишити балон на 2-3 хвилини, температура повітря в балоні зрівняється з кімнатною  . Тоді тиск в балоні буде
. Тоді тиск в балоні буде 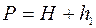 (1 стан повітря), де
(1 стан повітря), де  – атмосферний тиск, а
– атмосферний тиск, а 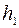 – різниця рівнів рідини в манометрі. Потім відкриємо на короткий час кран, щоб тиск в балоні зрівнявся з атмосферним
– різниця рівнів рідини в манометрі. Потім відкриємо на короткий час кран, щоб тиск в балоні зрівнявся з атмосферним  (при цьому рідини в манометрі зрівняються), після чого кран закриємо.
(при цьому рідини в манометрі зрівняються), після чого кран закриємо.
Повітря в балоні швидко розширюється до об’єму  (при цьому зважаючи на малий час розширення, помітного теплообміну між стінками балона і зовнішнім повітрям не буде). Температура зменшиться до
(при цьому зважаючи на малий час розширення, помітного теплообміну між стінками балона і зовнішнім повітрям не буде). Температура зменшиться до  (2 стан). Перехід повітря із стану 1 в стан 2 – адіабатичний. Отже, за рівнянням Пуассона:
(2 стан). Перехід повітря із стану 1 в стан 2 – адіабатичний. Отже, за рівнянням Пуассона:
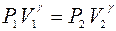 . (1)
. (1)
Чекаємо, поки температура повітря в балоні зрівняється з кімнатною 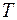 . Об’єм залишиться незмінним
. Об’єм залишиться незмінним  , тиск при нагріванні повітря збільшиться до
, тиск при нагріванні повітря збільшиться до 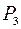 . Різниця рівнів буде
. Різниця рівнів буде 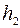 . Тоді
. Тоді 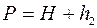 (3 стан).
(3 стан).
У 1 і 3 станах температура повітря однакова. Тоді на підставі закону Бойля-Маріотта:

 . (2)
. (2)
Розв’язуючи 1 і 2 відносно 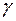 матимемо:
матимемо:
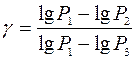 . (3)
. (3)
Розклавши 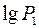 і
і 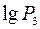 в ряд Тайлора і обмежившись двома першими членами, матимемо:
в ряд Тайлора і обмежившись двома першими членами, матимемо:
 . (4)
. (4)
Всі розглядувані процеси в балоні віднесемо до певної маси повітря, яке залишається в балоні під час досліду.
Опис приладу
Основою приладу є великий балон, сполучений гумовими трубками з відкритим манометром. В пробці, що закриває балон, є два крани. Один з них сполучає балон з манометром, другий – з навколишнім повітрям. Повітря нагнітається за допомогою насосу.
Порядок виконання роботи
1. Відкрити кран К2 (кран К1 закритий) і нагнітати в балон повітря, щоб в манометрі була значна різниця рівнів рідини. Закрити кран і записати різницю рівнів в манометрі, що остаточно встановилась.
2. Відкрити на короткий час кран К1. Рівні в манометрі зрівняються і кран закрити. Через 2-3 хв. зафіксувати 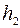 .
.
3. За формулою 4 обчислити 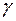 для повітря і порівняти з теоретично знайденим, вважаючи повітря двоатомним газом.
для повітря і порівняти з теоретично знайденим, вважаючи повітря двоатомним газом.
4. Дослід повторити 3-5 разів.
5. Дані вимірювань і обчислень занести в звітну таблицю, складену самостійно та підрахувати похибки.
Контрольні запитання
1. Що називається теплоємністю тіла?
2. Що називають питомою теплоємністю речовини?
3. Що називають молярною теплоємністю речовини?
4. Що таке 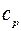 і
і 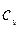 ?
?
5. Який газ називається ідеальним?
6. Вивести зв’язок між молярними теплоємностями при сталих тиску і об’єму для ідеальних газів (рівняння Маєра).
7. Що розуміють під ступенями вільності молекул газу?
8. Як залежить від числа ступенів вільності молекул молярні теплоємності газів та їх відношення  ?
?
9. Які процеси називаються ізотермічними, ізобаричними, ізохоричними, адіабатичними та якими законами вони характеризуються?
10. Вивести формулу для визначення відношення 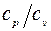 газів методом Клемана-Дезорма.
газів методом Клемана-Дезорма.
11. В якій послідовності виконується робота?
12. Чому один з кранів рекомендується відкривати тільки на короткий час і як це впливає на точність визначення?
13. Вивести формулу для визначення відносної та абсолютної похибки вимірюваень?