 |
|
Порядок выполнения работы
Определение парциальных молярных объемов
Компонентов бинарных растворов
План коллоквиума
Парциальные молярные величины. Методы определения парциальных молярных величин. Связь между парциальными молярными величинами компонентов раствора.
Цель работы
Определить парциальный молярный объем растворенного вещества и растворителя.
Общие положения
Все свойства растворов подразделяются на экстенсивные и интенсивные. Экстенсивные свойства (объем, масса внутренняя энергия, энтальпия) пропорциональны массе вещества. Экстенсивные свойства вещества являются аддитивными величинами. Если слить два объема воды, то объем новой системы будет равен сумме слитых. То же самое можно сказать и о внутренней энергии, энтальпии и других экстенсивных свойствах. Интенсивные свойства системы (давление, температура, плотность, молекулярная масса, молярная теплоемкость) не зависят от массы вещества. Величины интенсивных свойства в различных частях системы стремятся к выравниванию.
Изменение экстенсивного свойства раствора при добавлении в него какого-либо компонента характеризуется так называемыми парциальными величинами этого компонента. Парциальной молярной величиной раствора  компонента i называется частная производная от экстенсивного свойства раствора z по числу молей этого компонента ni при постоянных давлении, температуре и числах молей остальных компонентов:
компонента i называется частная производная от экстенсивного свойства раствора z по числу молей этого компонента ni при постоянных давлении, температуре и числах молей остальных компонентов:
 (1)
(1)
Соблюдение условий, требуемых этим определением, может быть достигнуто, если к весьма большому количеству раствора данной концентрации при постоянном давлении и температуре добавить 1 моль i-го компонента.
В формуле (1) заложена возможность экспериментального определения парциальных молярных величин, в частности, парциального молярного объема. Согласно ей парциальный молярный объем растворенного вещества бинарного раствора
 (2)
(2)
где V – общий объем раствора. Поэтому, если экспериментально определить объемы растворов, содержащих неизменное количество растворителя (n1 = const), но разное количество растворенного вещества (n2), то по графику зависимости объема раствора от числа молей растворенного вещества можно вычислить парциальный молярный объем растворенного вещества как угловой коэффициент касательной к кривой в точке, соответствующей заданной концентрации раствора.
Общий объем бинарного раствора, состоящего из n1 и n2 молей растворенного вещества, может быть выражен через парциальные молярные объемы компонентов:
 (3)
(3)
Эта формула позволяет рассчитать парциальный молярный объем растворителя.
Порядок выполнения работы
1. Из раствора соли с моляльной концентрацией 3,0 m готовят методом разбавления растворы 0,5; 1,0; 1,5; 2,0; 2,5 m.
Для опыта могут быть взяты растворы солей (NaCl, КСl, MgSO4, K2SO4), моляльность которых изменяется от 0 до 3,0.
2. Взвешивают чистый сухой пикнометр на аналитических весах, qп. Затем заполняют его дистиллированной и закрывают пробкой, вытесняя избыток воды. Пикнометр насухо вытирают фильтровальной бумагой и снова взвешивают, qо. По разности весов qо – qп определяют массу воды в пикнометре 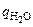 , и, используя данные о плотности воды при различных температурах (табл. 1), вычисляют объем пикнометра Vп.
, и, используя данные о плотности воды при различных температурах (табл. 1), вычисляют объем пикнометра Vп.
Таблица 1
Плотность дистиллированной воды
| Температура, °С | Плотность воды, г/см3 |
| 0,9993 | |
| 0,9991 | |
| 0,9990 | |
| 0,9988 | |
| 0,9986 | |
| 0,9984 | |
| 0,9982 | |
| 0,9980 | |
| 0,9978 | |
| 0,9976 | |
| 0,9973 | |
| 0,9971 |
3. Предварительно ополоснув пикнометр исследуемым раствором соли, заполняют его этим раствором с известной концентрацией. Взвешивают пикнометр с раствором (q) и заносят результаты в таблицу 2.