 |
|
Физические свойства
Получение
1. Каталитическое окисление аммиака (промышленный способ)
4NH3 +5O2  4NO + 6H2O
4NO + 6H2O
2. 3Cu + 8HNO3(разб.) → 3Cu(NO3)2 + 2NO + 4H2O
3. N2 + O2 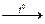 2NO (в природе, во время грозы)
2NO (в природе, во время грозы)
Химические свойства
1. Легко окисляется кислородом и галогенами
2NO + O2 →2NO2 2NO + Cl2 → 2NOCl(хлористый нитрозил)
2. Окислитель 2N+2O + 2S+4O2 → 2S+6O3 + N20
3. Несолеобразующий оксид
Оксид азота (III) N2+3O3
Физические свойства
Темно-синяя жидкость (при низких температурах), t0пл.= -1020C, t0кип.= 3,50С; Выше t0кип. разлагается на NO и NO2. N2O3 соответствует азотистой кислоте (HNO2), которая существует только в разбавленных водных растворах.
Получение NO2 + NO → N2O3
Химические свойства
Все свойства кислотных оксидов.
N2O3 + 2NaOH →2NaNO2(нитрит натрия) + H2O
Оксид азота (IV) N+4O2 диоксид азота
Физические свойства
Бурый газ, запах резкий, удушливый, ядовит, t0пл.= -11,20C, t0кип.= 210С.
Получение
1. 2NO + O2 → 2NO2
2. Cu + 4HNO3(конц.) → Cu(NO3)2 + 2NO2 + 2H2O
Химические свойства
1. Кислотный оксид, с водой 2NO2 + H2O → HNO3 + HNO2 4NO2 + 2H2O + O2 → 4HNO3
со щелочами 2NO2 + 2NaOH → NaNO2 + NaNO3 + H2O
2. Окислитель N+4O2 + S+4O2 → S+6O3 + N+2O
3. Димеризация 2NO2(бурый газ)→N2O4(бесцветная жидкость)
В атмосфере NO2 вещества горят
2NO2+2S→N2+2SO2 10NO2+4P→5N2+4P2O5(>100oC) 2NO2+4Cu→N2+4CuO
Оксид азота (V) N2+5O5
Физические свойства
Кристаллическое вещество, летучее, неустойчивое.
Получение
1. 2NO2 + O3 → N2O5 + O2
2. 2HNO3 +P2O5 → 2HPO3 + N2O5
Химические свойства
1. Кислотный оксид N2O5 + H2O → 2HNO3
2. Сильный окислитель
3. Легко разлагается (при нагревании - со взрывом): 2N2O5 → 4NO2 + O2
Азотистая кислота
HNO2 H–O–N=O
Физические свойства
Существует только в разбавленных водных растворах.
Получение AgNO2 + HCl → HNO2 + AgCl↓
Химические свойства
1. Слабая кислота; ее соли (нитриты) – устойчивы: HNO2 + NaOH → NaNO2 + H2O
2. Разлагается при нагревании: 3HNO2 →HNO3 + 2NO + H2O
3. Слабый окислитель (окислительные свойства проявляет только в реакциях с сильными восстановителями) 2KNO2 + 2KI + 2H2SO4 → 2K2SO4 + I2 + 2NO + 2H2O
2I- - 2ē → I20 1
NO2- + 2H+ + 1ē → NO + H2O 2
2I- + 2NO2- + 4H+ → I20 + 2NO + 2H2O
4. Сильный восстановитель: HNO2 + Cl2 + H2O → HNO3 + 2HCl
5. Нитриты в щелочной среде с цинком, алюминием и бериллием восстанавливаются до аммиака:
3KNO2 + 6Al + 3KOH + 15H2O→6K[Al(OH)4] +3NH3
Азотная кислота HNO3
Физические свойства Бесцветная жидкость, неограниченно растворимая в воде; t0пл.= -410C; t0кип.= 82,60С, ρ = 1,52 г/см3
Получение
1. Лабораторный способ KNO3 + H2SO4(конц) 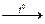 KHSO4 + HNO3
KHSO4 + HNO3
2. Промышленный способ. Осуществляется в три этапа:
a) Окисление аммиака на платиновом катализаторе до NO
4NH3 + 5O2  4NO + 6H2O
4NO + 6H2O
б) Окисление кислородом воздуха NO до NO2: 2NO + O2 → 2NO2
в) Поглощение NO2 водой в присутствии избытка кислорода
4NO2 + О2 + 2H2O → 4HNO3
Химические свойства
Очень сильная кислота. Диссоциирует в водном растворе практически нацело:
HNO3 → H+ + NO3-
Реагирует:
с основными оксидами CuO + 2HNO3 → Cu(NO3)2 + H2O
CuO + 2H+ + 2NO3- → Cu2+ + 2NO3- + H2O или CuO + 2H+ → Cu2+ + H2O
с основаниями HNO3 + NaOH → NaNO3 + H2O H+ + NO3- + Na+ + OH- → Na+ + NO3- + H2O
или H+ + OH- → H2O
вытесняет слабые кислоты из их солей 2HNO3 + Na2CO3 → 2NaNO3 + H2O + CO2
2H+ + 2NO3- + 2Na+ + СO32- → 2Na+ + 2NO3- + H2O + CO2 2H+ + СO32- → H2O + CO2
Специфические свойства азотной кислоты
Сильный окислитель
1. Разлагается на свету и при нагревании 4HNO3 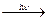 2H2O + 4NO2 + O2
2H2O + 4NO2 + O2
2. Окрашивает белки в оранжево-желтый цвет (при попадании на кожу рук - "ксантопротеиновая реакция")
3. При взаимодействии с металлами никогда не выделяется водород
металл + HNO3 → соль азотной кислоты + вода + газ
в) HNO3 – окислитель.
Продукты восстановления HNO3 зависят от 2-х факторов: силы восстановителя и концентрации кислоты. Чем сильнее восстановитель и чем более разбавлена кислота, тем более низкую степень окисления имеет азот (N) в продуктах восстановления HNO3:
| восстановитель концентрация HNO3 | щелочные и щелочноземельные металлы | тяжелые металлы |
| разбавленная кислота | N–3H4NO3 | N+2O |
| концентрированная кислота | N2+1O | N+4O2 |
HNO3 не взаимодействует с Au, Pt, Ir, Os.
HNO3(конц.) взаимодействует с Al, Cr, Fe ТОЛЬКО при t°
NO3- + 2H+ + 1e → NO2 + H2O, (1)
NO3- + 4H+ + 3e → NO + 2H2O, (2)
2NO3- + 10H+ + 8e → N2O + 5H2O, (3)
2NO3- + 12H+ + 10e → N2 + 6H2O, (4)
NO3- + 10H+ + 8e → NH4+ + 3H2O. (5)
***С одним и тем же восстановителем, например цинком, кислота, если она концентрированная, будет обязательно реагировать по схеме (1) с выделением NО2; если НNО3 разбавленная, то она может взаимодействовать с Zn по любой схеме (2)-(5), в зависимости от степени разбавления.
4. С неметаллами:
Азотная кислота превращается в NO (или в NO2); неметаллы окисляются до соответствующих кислот: S0 + 6HNO3(конц) → H2S+6O4 + 6NO2 + 2H2O (нагревание)
B0 + 3HNO3 →H3B+3O3 + 3NO2 3P0 + 5HNO3 + 2H2O(разб) →5NO + 3H3P+5O4
I2+10HNO3(к) ®2HIO3+10NO2 ↑+4H2O 3I2+10HNO3(разб) ®6HIO3+10NO↑+2H2O
5. Азотная кислота окисляет сложные вещества; при этом может происходить окисление одного из элементов: FeO + 4HNO3(конц) ®Fe(NO3)3 + NO2 + 2H2O
или двух атомов одновременно: Cu+12S-2 + 14HNO3(конц) → 2Cu+1(NO3)2 + H2S+6O4 + 10NO2↑+ 6H2O
«Царская водка»
HNO3 (конц) + 3HCl (конц) ↔NOCl + 2Cl0 + 2H2O (комн. темп)
2HNO3 (конц) + 6HCl (конц)→2NO + 3Cl2 + 4H2O
HNO3 (конц) + 4HCl (конц) + Au →H[AuCl4] + NO + 2H2O
4HNO3 (конц) + 18HCl (конц) + 3Pt →3H2[PtCl6] + 4NO + 8H2O
NOCl – оранжево–желтый газ, желтовато–красная жидкость, термически неустойчивое вещество, разлагается при комнатной температуре:
2NOCl ↔2NO + Cl2 Сильно корродирует металлы: 3NOCl + Fe → FeCl3 + 3NO (при комн. темп.)