 |
|
При связывании инициаторных белков IF-1 и IF-2 с 30S-субчастицей происходит диссоциация 70S-рибосомы на две субъединицы.
Структура ДНК
Еще в 1869 году швейцарский биохимик Фридрих Мишер обнаружил в ядре клеток соединения с кислотными свойствами и с еще большей молекулярной массой, чем белки. Альтман назвал их нуклеиновыми кислотами, от латинского слова «нуклеус» - ядро. Так же, как и белки, нуклеиновые кислоты являются полимерами. Мономерами их служат нуклеотиды, в связи с чем нуклеиновые кислоты можно еще назвать полинуклеотидами. Нуклеиновые кислоты были найдены в клетках всех организмов, начиная от простейших и кончая высшими. Самое удивительное, что химический состав, структура и основные свойства этих веществ оказались сходными у разнообразных организмов. Но если в построении белков принимают участие около 20 видов аминокислот, то разных нуклеотидов, входящих в состав нуклеиновых кислот, всего четыре. В живых клетках содержится два типа нуклеиновых кислот –дезоксирибонуклеиновая (ДНК) и рибонуклеиновая (РНК). Как ДНК, так и РНК несут в себе нуклеотиды, состоящие из трех компонентов: азотистого основания, углевода, остатка фосфорной кислоты. Однако комбинация этих компонентов в ДНК и РНК несколько различны[2].
Дезоксирибонуклеиновая кислота (ДНК) — макромолекула, обеспечивающая хранение, передачу из поколения в поколение и реализацию генетической программы развития и функционирования живых организмов. ДНК содержит информацию о структуре различных видов РНК и белков.
В клетках эукариот ДНК находится в ядре клетки в составе хромосом, а также в некоторых клеточных органоидах (митохондриях и пластидах). В клетках прокариотических организмов (бактерий и архей) кольцевая или линейная молекула ДНК, так называемый нуклеоид, прикреплена изнутри к клеточной мембране. У них и у низших эукариот (например, дрожжей) встречаются также небольшие автономные, преимущественно кольцевые молекулы ДНК, называемые плазмидами. Кроме того, одно- или двухцепочечные молекулы ДНК могут образовывать геном ДНК-содержащих вирусов.
Уотсон и Крик предложили, что природная (нативная) структура ДНК представляет собой две полимерные цепи, соединенные между собой и закрученные в виде двойной спирали. Основная структурная единица цепи – нуклеотид. Он состоит из трех химически различных частей, соединенных ковалентной связью: дезоксирибозы, азотистого основания и фосфатной группы.
ДНК содержат пуриновые азотистые основания: аденин и гуанин; и пиримидиновые азотистые основания: цитозин и тимин. Азотистое основание ковалентно соединено с первым атомом углерода сахара и формирует структуру, называемую нуклеозидом. Фосфатные труппы соединяют нуклеозиды в полимерную цепочку посредством фосфодиэфирных связей между 5'-атомом углерода одного сахара и З'-атомом углерода другого атома. Сцепление между цепями обеспечивается особыми водородными связями между аденином и тимином и между гуанином и цитозином.
Последовательно расположенные нуклеотиды в молекулах ДНК ковалентно связаны друг с другом при помощи фосфатных «мостиков». 5'-гидроксильная группа пентозы одного нуклеотида присоединена к З'-гидроксильной группе пентозы соседнего нуклеотида с помощью фосфодиэфирной связи. Таким образом, ковалентные остовы нуклеиновых кислот состоят из монотонно чередующихся фосфатных и пентозных групп; основания же можно рассматривать как боковые группы, присоединенные к остову на равных расстояниях друг от друга. Отметим также, что сахарофосфатный остов и ДНК несет заряд, поскольку фосфатные группы являются кислыми и при характерных для клеток рН заряжены отрицательно. Вместе с тем пуриновые и пиримидиновые основания, которые плохо растворимы в воде, гидрофобны. Укажем также, что цепи ДНК обладают определенной полярностью, или направлением, поскольку все межнуклеотидные фосфодиэфирные связи ориентированы вдоль цепи одинаково. Благодаря этой полярности каждая полинуклеотидная цепь имеет 5'-конец и З'-конец. Структура ковалентного остова ДНК, в которой следующие друг за другом нуклеотидные единицы (в ДНК эти нуклеотидные единицы закрашены) соединяются между собой фосфодиэфирными мостиками. Обратите внимание на то, что остов, состоящий из чередующихся остатков пентозы и фосфатных групп, представляет собой сильно полярную часть молекулы, тогда как основания это неполярные, гидрофобные компоненты молекулы.
Межнуклеотидные связи в ДНК можно химически расщепить с помощью гидролиза. Их можно гидролизовать и ферментами, которые называются нуклеазами. Некоторые нуклеазы способны расщеплять связи между двумя соседними нуклеотидами, расположенными внутри цепи ДНК; такие нуклеазы называют эндонуклеазами. Нуклеазы другого класса могут катализировать гидролиз только связи концевого нуклеотида или у 5'- или у З'-конца молекулы; эти ферменты относятся к экзонуклеазам. Дезоксирибонуклеазы, специфически расщепляющие определенные межнуклеотидные связи в ДНК найдены во всех живых клетках. Они секретируются, в частности, поджелудочной железой в кишечный тракт, где принимают участие в гидролизе нуклеиновых кислот в процессе пищеварения. Ниже мы увидим, что различные типы эндонуклеаз представляют собой важный биохимический инструмент для контролируемого расщепления ДНК на меньшие фрагменты при определении их нуклеотидной последовательности [3].
Водородные связи намного слабее ковалентных, соединяющих отдельные атомы каждого нуклеотида, но достаточно сильны, чтобы обеспечить специфичность образования пар аденин - тимин, гуанин – цитозин. Такое попарное сопоставление нуклеотидов, при котором аденин комплиментарен тимину, а гуанин комплиментарен цитозину, было выведено с помощью построеия молекулярных моделей, в которых точно воспроизводились в масштабе все межатомные расстояния. Пространственная модель молекулы ДНК показала характер закрученности цепей друг относительно друга и плотность упаковки пар азотистых оснований в двойной спирали. Кроме того, построение молекулярной модели гипотетической двойной спирали потребовало «антипараллельности» нуклеотидных цепочек, что показано на рис.1.
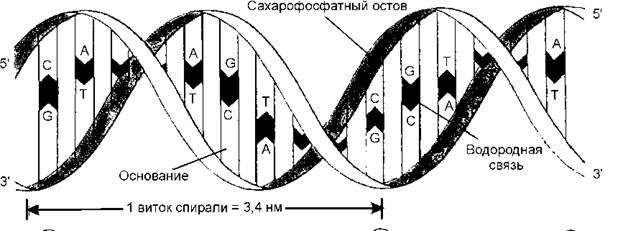
Рис.1 Строение молекулярной модели двойной спирали ДНК
Нуклеиновые кислоты — это очень длинные полимерные цепочки. Для любой последовательности азотистых оснований возможна равная ей по длине комплиментарная последовательность, составляющая вторую цепь двойной спирали. Конкретная последовательность пар А-Т и Г-Ц не влияет на структуру молекулы ДНК, образующей двойную спираль. Возможное число различных последовательностей пар оснований в молекуле ДНК практически бесконечно и способно кодировать колоссальное количество информации. Из модели следует, что физическая структура природной ДНК может сильно изменяться при нагревании или титровании, когда не нарушаются ковалентные, но разрываются водородные связи, в результате чего цепи отделяются друг от друга. Поскольку цепи ДНК комплиментарны каждая из них при расплетании двойной спирали способна служить матрицей для синтеза новой комплиментарной цепи. Последовательность оснований во вновь синтезируемой цепи будет определяться спецификой водородных связей между азотистыми основаниями родительской и вновь синтезируемой цепи. Таким образом, генетическая информация, содержавшаяся в последовательности пар оснований родительской молекулы, будет полностью воспроизведена в двух дочерних молекулах. Более того, если в процессе удвоения ДНК произошла ошибка и какой-либо нуклеотид во вновь образуемой цепи выпал или оказался некомплиментарным исходному, то это может изменить информационное содержание молекулы, причем логично ожидать, что эта ошибка будет передана дочерним молекулам ДНК в следующих поколениях. Такая замена пары нуклеотидов будет обладать свойствами генетических мутаций.
Репликация
Формулируя свою модель, Д. Уотсон и Ф. Крик предположили, что репликация ДНК происходит в несколько последовательных этапов, а именно: а) разрыв водородных связей между двумя полинуклеотидными цепями и разделение последних; б) разматывание полинуклеотидных цепей; в) синтез вдоль каждой из полинуклеотидных цепей новой цепи с комплементарной последовательностью азотистых оснований. Они предположили далее, что разделение и разматывание полинуклеотидных цепей начинается с одного конца молекулы, продолжается по направлению к другому ее концу и сопровождается одновременно идущим с того же конца молекулы синтезом новых полинуклеотидных цепей. Таким образом, в репликации ДНК каждая полинуклеотидная цепь действует в качестве шаблона для вновь синтезируемой полинуклеотидной цепи, причем шаблон обеспечивает выбор определенных нуклеотидных последовательностей из всех возможных последовательностей. В результате этого каждая новая молекула ДНК состоит из одной старой цепи и одной новой (дочерней), комплементарной старой. Этот способ репликации ДНК получил название полуконсервативной репликации.
У прокариотов репликация ДНК начинается с 0 - пункта репликации, составленного примерно 300 нуклеотидами, и продолжается в двух направлениях, образуя репликационную «вилку». Удвоение молекулы ДНК происходит за 40 минут. Кроме того, у прокариотов действует механизм «вращающееся кольцо», по которому репликационная вилка двигается вокруг кольца, генерируя цепи, на которых синтезируются комплементарные цепи.
Изучение ферментативного синтеза ДНК in vitro, компонентами которого являются ДНК-полимераза, дезоксирибонуклеозид 5'-трифосфаты всех четырех азотистых оснований, ионы магния и ДНК-«затравка», показало, что присутствие всех этих компонентов в смеси сопровождается добавлением мононуклеотидов к растущему концу цепи ДНК, причем они добавляются к 3'-гидроксильному концу «затравочной» последовательности, и цепь растет в направлении от 5'- к 3'-концу. Реакция катализируется ДНК-полимеразой III. После добавления в смесь ДНК-«затравки» синтез ДНК не прекращается даже тогда, когда количество вновь синтезированной ДНК достигает количества ДНК-«затравки». Если же один из компонентов в смеси отсутствует, частота полимеризации снижается во много раз. Отсутствие ДНК-«затравки» полностью исключает реакцию.
Изучение ферментативного синтеза ДНК in vitro показало также, что копируются обе цепи, но т. к. цепи ДНК в спирали антипараллельны, то синтез (полимеризация) одной цепи происходит в направлении от 5' к 3'-концу, тогда как другой — от 3' к 5'-концу. Синтез цепи в направлении от 5'- к 3'-концу является непрерывным, тогда как синтез в направлении от 3'- к 5'— прерывен, поскольку синтезируются короткие сегменты в направлении от 5' к 3'-концу, которые затем воссоединяются ДНК-лигазой. Короткие сегменты по 1000-2000 нуклеотидов получили название фрагментов Оказаки. Следовательно, рост обеих цепей обеспечивается одной и той же полимеразой. Репликационная вилка асимметрична. Цепь, синтезируемую непрерывно, называют лидирующей, тогда как цепь, синтезируемую прерывно, называют «запаздывающей». «Запаздывание» второй цепи связано с тем, что синтез каждого фрагмента Оказаки осуществляется только тогда, когда в результате продвижения лидирующей цепи откроется необходимый участок цепи-шаблона.
В случае синтеза лидирующей цепи у ДНК-полимеразы имеется спаренный 3'-конец, что позволяет начать полимеризацию следующей (новой) цепи. Однако для ДНК полимеразы, синтезирующей «запаздывающую» цепь, необходима «затравка», обладающая спаренным 3'-концом (3'-гид-роксильной группой). Эту затравку в виде коротких сегментов РНК синтезирует из рибонуклеотидтрифосфатов ДНК-примаза на ДНК-шаблоне запаздывающей цепи.
РНК «затравливает» каждую новую инициацию синтеза ДНК. Затем включается ДНК-полимераза, полимеризуя 5'-фосфатдезокси-рибонуклеотидного остатка с 3'-гидроксильным концом цепи РНК, что приводит к нормальному синтезу цепи ДНК. В последующем «затравочная» последовательность РНК удаляется, и брешь заполняется ДНК. Таким образом, роль «затравки» в синтезе фрагментов Оказаки выполняет РНК.
Репликация ДНК эукариотов характеризуется теми же механизмами, что и у прокариотов, хотя скорость полимеризации цепей является меньшей (около 50 нуклеотидов в секунду у млекопитающих). В репликации ДНК эукариотов принимают участие те же ферменты, что и в случае прокариотов. Размеры фрагментов Оказаки здесь составляют 100-200 нуклеотидов.
Раскручивание двойной цепи ДНК происходит с участием трех разных белков, а именно: а) белки, дестабилизирующие спираль. Они связываются с одноцепочечными ДНК, помогают ДНК-геликазам раскручивать спираль и обеспечивают протяженный одноцепочечный шаблон для полимеризации; б) ДНК-геликазы, раскручивающие ДНК. Они прямо вовлечены в катализирова-ние раскручивания; в) ДНК-гиразы, которые катализируют формирование негативных супервитков в ДНК.
У эукариотов известно пять ДНК-полимераз (a, b, g, d и e), из которых главную роль в репликации играют полимеразы a и d.
a—Полимераза начинает синтез на ведущей (лидирующей) и запаздывающей цепях, поскольку только она обладает «затравочной» активностью. Дальнейшую элонгацию лидирующей цепи осуществляет b-фермент, а «запаздывающей» цепи —e - или d-ферменты. g-фермент, который является митохондриальным, завершает репликацию «запаздывающей» цепи. Установлен также белок (циклин), который также необходим для репликации ДНК.
Спирализацию ДНК после репликации обеслечивают ферменты ДНК-топоизомеразы. Процесс репликации ДНК характеризуется исключительной точностью. Как отмечено выше, фрагменты Оказаки, продуцируемые в ДНК у эукариот, имеют длину от 100 до 20 пар нуклеотидов. Это, возможно, связано с тем, что у эукариотов синтез ДНК является более медленным (1 молекула ДНК в минуту) по сравнению с прокариотами (30 молекул ДНК в минуту).
Удвоение хромосом эукариотов является сложным процессом, поскольку включает не только репликацию гигантских молекул ДНК, но также и синтез связанных с ДНК гистонов и негистоновых хромосомных белков. Конечным этапом является упаковка ДНК и гистонов в нуклеосомы.
Репликационное поведение хромосом основывается на трех фундаментальных свойствах, а именно: непосредственно репликация, сегрегация хромосом при репликации ДНК и делении клеток, а также репликация и предохранение концов хромосом. 0-пункты репликации существуют в хромосомах (сайты инициации репликации) также организмов-эукариотов, состоящих из определенных последовательностей азотистых оснований, причем являются множественными. Эти пункты получили название автономно реплици-рующихся последовательностей. Определяя количество репликационных вилок, они удалены один от другого на расстоянии 30 000-300 000 пар азотистых оснований. В результате этого по каждой хромосоме двигается много репликационных «вилок», причем одновременно и независимо одна от другой. Инициацию репликации ДНК обеспечивают белки, связанные с 0-пунктом репликации, а также белки — киназы. Последние ответственны за выход ДНК из репликации. Но как действуют эти механизмы — это вопрос, который еще не получил разрешения.
За сегрегацию хромосом в дочерние клетки ответственны центромеры.
В репликации и предохранении концов хромосом имеют значение так называемые теломеры, представляющие собой повторяющиеся последовательности ДНК длиной 5—10 азотистых оснований. Их роль заключается в обеспечении доступа ДНК-полимеразы к концам цепей ДНК. Вновь образованные хромосомы содержат как старые гистоны, так и вновь синтезированные, контроль которых у млекопитающих осуществляется 20 генными блоками, каждый из которых содержит по 5 гистоновых генов [5].
Транскрипция
Транскрипция – первая стадия реализации генетической информации в клетке.
Входе процесса образуются молекулы мРНК, служащие матрицей для синтеза белков, а так же транспортные, рибосомальные и другие виды молекул РНК, выполняющие структурные, адапторные и каталитические функции.
Транскрипция у эукариотов происходит в ядре. В основе механизма транскрипции лежит тот же структурный принцип комплиментарного спаривания оснований в молекуле РНК (гуанин – цитозин, тимин – аденин, аденин – урацил). ДНК служит только матрицей в и в ходе транскрипции не изменяется.
Синтез молекулы РНК начинается в определенных последовательностях (сайтах) ДНК, которые называют промотеры, и завершаются в терминирующих участках (сайты терминации). Участок ДНК, ограниченный промотером и сайтом терминации, представляет собой единицу транскрипции – транскриптон. У эукариотов в состав транскриптона входит один ген, у прокариотов – несколько. В каждом транскриптоне присутствует неинформативная зона; она содержит специфические последовательности нуклеотидов, с которыми взаимодействуют регуляторные транскрипционные факторы (белки, взаимодействующие с определенными регуляторными сайтами ускоряющими или замедляющими процесс транскрипции).
Соседние транскриптоны могут быть отделены друг от друга нетранскрибируемыми участками ДНК. Разделение ДНК на множество транскриптонов позволяет осуществлять с разной активностью индивидуальное считывание (транскрипцию) с отдельных генов.
В транскриптоне кодируется только одна цепь ДНК, которая называется матричной, другая, комплиментарная ей, называется кодирующей. Синтез РНК идет от 5’- к 3’- концу, при этом матричная цепь ДНК всегда антипараллельна синтезируемой нуклеиновой кислоте. Биосинтез РНК осуществляется ДНК – зависимыми РНК – полимеразами.
В процессе транскрипции различают 3 стадии: инициацию, элонгацию и терминацию.
Инициация.
Активация просмотра начинается при помощи большого белка – ТАТА – фактора, так как он взаимодействует со специфической последовательностью нуклеотидов промотора - ТАТААА (ТАТА – бокс). Присоединение ТАТА – фактора облегчает взаимодействие промотора с РНК – полимеразой. Факторы инициации вызывают изменение конформации РНК – полимеразы и обеспечивают раскручивание одного витка спирали с образованием транскрипционной вилки, где матрица доступна для инициации синтеза РНК. После того как был синтезирован олигонуклеотид из 8-10 нуклеотидных остатков,  - субъединица отщепляется от РНК – полимеразы и на ее место к молекуле фермента встает фактор элонгации.
- субъединица отщепляется от РНК – полимеразы и на ее место к молекуле фермента встает фактор элонгации.
Элонгация.
Факторы элонгации повышают активность РНК – полимеразы и облегчают расхождение цепей ДНК. Синтез молекулы РНК идет от 5’- к 3’- концу комплиментарно матричной цепи ДНК. Растущий конец РНК образует временную гибридную цепь, около 12 нуклеотидных остатков, с матричной ДНК. По мере продвижения РНК – полимеразы по матрице в направлении от 3’- k 5’- концу впереди нее происходит расхождение, а позади восстановление двойной спирази ДНК.
Терминация.
Раскручивание двойной спирали в области сайта терминации делает его доступным для фактора терминации. Завершается синтез РНК в терминаторах. Фактор терминации облегчает отделение первичного транскрипта (пре - мРНК), комплиментарнго матрице, и РНК – полимеразы от матрицы. РНК – полимераза может вступить в следующий синтез послеприсоединения субъединицы  [6].
[6].
Трансляция
Процесс белкового синтеза протекает в пять основных этапов: 1)активации аминокислот; 2) инициации полипептидной цепи; 3) элонгации; 4) терминации; 5) сворачивания и процессинга белков.
1. Активация аминокислот.
В данном процессе происходит сопряжение аминокислоты с ее антикодоном. На этом этапе биосинтеза белка, протекающем в цитозоле белка, двадцать аминокислот присоединяются с помощью эфирной связи к соответствующим тРНК. Эти процессы катализируются двадцатью различными ферментами – аминоацил – тРНК – синтетазами.каждый из эти хферментов специфичен по отношению к одной аминокислоте и к соответствующей тРНК.
Процесс активации аминокислот включает в себя две стадии, осуществляемые в каталитическом центре фермента.
На первой стадии в активном центре фермента происходит взаимодействие АТФ и аминокислоты и образуется связанное с ферментом промежуточное соединение – аминоациладенилат. В ходе реакции карбоксильная группа аминокислоты соединяется ангидридной связью с 5’-фосфатной группой АМФ, вытесняя при этом пирофосфат.
На второй стадии аминоацильный остаток связывается со свободной 2’- или 3’- гидроксильной группой концевого остатка аденина в молекуле тРНК. Образующийся в процессе активации неорганический пирофосфат гидролизуется пирофосфатазой до ортофосфата. Таким образом, на активацию каждой аминокислоты затрачивается две высокоэнергетические фосфатные связи.
Каждая молекула тРНК может участвовать в качестве «носителя» многократно. Освободившись от предыдущей молекулы аминокислоты, тРНК способна связывать очередную молекулу аминокислоты того же вида с помощью соответствующей аминоацил – тРНК – синтетазы. После присоединения соответствующей тРНК аминокислота сама участвует в определении специфичности аминоацил – тРНК, так как сама аминоацильная группа не узнается ни рибосомой, ни структурой тРНК. Таким образом, тРНК играет роль адоптора.
2. Инициация полипептидной цепи.
Синтез полипептидной цепи начинается с N – конца, к которомы один за другим присоединяются аминокислотные остатки, и полипептидная цепь растет в направлении к С – концу. Начальным N-концевым остатком является остаток N-формилметионина. В процессе трансляции он вступает в составе N-формилметионил-тРНК. Синтезируемые в митохондриях и хлоропластах белки всегда начинаются с N-формилметионина.
Инициация синтеза полипептидов проходит в несколько стадий. Для инициации полипептидной цепи необходимы:1)3OS-субчастица;2)мРНК, кодирующая полипептид; 3) инициирующая N-формилметионил-тРНК; 4)белки - факторы инициации (IF-1,IF-2,IF-3)
Этапы инициации трансляции:
Факторы инициации IF-1 и IF-3 связываются с 30S-субчастицей, что обеспечивает ее взаимодействие с IF-2, инициаторной формилметиониновой-тРНК.
При связывании инициаторных белков IF-1 и IF-2 с 30S-субчастицей происходит диссоциация 70S-рибосомы на две субъединицы.
Комплекс 30S-субъединицы со всеми факторами инициации и N-формилметионил-тРНК связывается с 5'-концом мРНК вблизи кодона AУГ и узнает. AУГ-кодон мРНК.
Связывание 30S-субчастицы с мРНК находится под строгим контролем нуклеотидной последовательности, расположенной примерно за 10 нуклеотидов до 5'-конца инициаторного кодона. Взаимодействию способствует комплементарное спаривание этой богатой пуринами последовательности из 5-8н, называемойпоследовательностью Шайна-Дальгарно, с полипиримидиновым участком, находящимся вблизи 3'-конца 16S-pPHK.
Формирование полноценного функционального комплекса инициации завершается ассоциацией 50S-субчастицы с преинициаторным комплексом. При ассоциации 70S-рибосомы образуются два активных центра: П (пептидильный) - и А (аминокислотный) -участки. N-формилметионил-тРНК занимает П-участок.
С образованием функциональной 70S-субчастицы отделяются все три белка инициации.
Антикодоновый триплет инициирующий аминоацил-тРНК образует комплиментарные пары с антипараллельно расположенным триплетом в мРНК. Инициирующая аминоацил-тРНК присоединяется к пептидильному рибосомы. Вновь поступающие аминоацил-тРНК присоединяются к А-участку, тогда как П-участок – это такое место рибосомы, с которого уходят освободившиеся от аминокислот тРНК. К этому же участку оказывается прикрепленной растущая пептидил-тРНК. Инициирующий комплекс готов к процемму элонгации.
3. Элонгация.
Это основной и самый продолжительный этап белкового синтеза, в ходе которого происходит удлинение полипептидной цепи за счет последовательного присоединения аминокислот. Начинается с момента образования первой пептидной связи и заканчивается после включения в полипептидную цепь последней аминокислоты.
Элонгация у бактерий осуществляется при участии трех белковых факторов (EF-Tu, EF-Ts, EF-G) и имеет циклический характер.
Цикл элонгации включает 3 стадии:
1. Связывание тРНК с аминоацильным центром рибосомы. На этой стадии со свободным А-центром рибосомы связывается очередная тРНК – та, чей антикодон комплементарен кодону мРНК, находящемуся в А-центре. Поступив в А-центр, аа-тРНК закрепляется в нем в комплексе с белковым фактором EF-Tu (EF – Elongation Factor) и ГТФ. При участии фактора EF-Тu осуществляется гидролиз ГТФ до ГДФ и Фн, а выделяющаяся энергия расходуется на сближение двух аминокислотных остатков. Комплекс EF-Tu·ГДФ при этом покидает рибосому и регенерируется с участием фактора EF-Ts, так что фактор EF-Tu вновь оказывается связанным с молекулой ГТФ.
2. Образование пептидной связи. В рибосоме после первой стадии цикла находятся пептидил-тРНК (в П-центре) и аа-тРНК (в А-центре). При этом их акцепторные петли и связанные с ними аминокислотные остатки располагаются в каталитическом (К-) центре. Последний осуществляет пептидилтрансферазную реакцию: переносит пептидил (или инициирующую аминокислоту – формилметионин у прокариот) на аминокислоту поступившей аа-тРНК. Прежняя тРНК пептидила становится свободной
В ходе пептидилтрасферазной реакции карбоксильная группа пептидила образует пептидную связь с аминогруппой очередной аминокислоты. Таким образом, рост пептидной цепи при трансляции происходит в направлении от N- к С-концу.
3. Транслокация – перемещение пептидил-тРНК из А-центра в П-центр в результате передвижения рибосомы по мРНК на один кодон. Свободная тРНК вытесняется из рибосомы, и одновременно освобождается А-центр, необходимый для связывания следующей аа-тРНК. Транслокация идет с участием белкового фактора EF-G (у бактерий) и сопровождается гидролизом одной молекулы ГТФ.
Таким образом, удлинение пептидной цепи на один аминокислотный остаток требует расхода двух молекул ГТФ (одна идет на связывание аа-тРНК, вторая – на траслокацию). Многократное повторение циклов элонгации приводит к включению в строящуюся пептидную цепь аминокислотных остатков в соответствии с последовательностью кодонов в мРНК.
Терминация.
Факторы терминации:
RF-1 вызывает отделение полипептидной цепи при считывании кодонов УАА и УАГ;
RF-2 действует аналогичным образом при считывании УАА и УГА,
EF-3 может облегчить работу двух других факторов.
Этапы терминации трансляции:
1. В А-участке оказывается один из трех терминирующих кодонов – УАГ, УАА или УГА. Из-за отсутствия тРНК, отвечающих этим кодонам, полипептидил-тРНК остается связанной с П-участком.
2. RF-1 и RF-2 катализируют отсоединение полипептидной цепи от тРНК. RF-1 узнает в А-участке кодон УАА или УАГ; RF-2 включается в том случае, когда в А-участке оказывается УАА или УГА; RF-3 облегчает работу двух других факторов. Если терминирующим кодоном является UAA, то эффективность процесса терминации оказывается наибольшей, поскольку этот кодон узнают оба фактора – RF-1 и RF-2. Однако, каким бы из стоп-кодонов ни обеспечивалась терминация,ее эффективность зависит от фланкирующих эти кодоны последовательностей в мРНК.
Когда расстояние от рибосомы до сайта инициации достигнет величины 100–200 нуклеотидов, в этом сайте может произойти новая инициация трансляции. Таким образом на одной мРНК может находится несколько транслирующих рибосом – полирибосомы.
Терминирующий кодон узнается уже не антикодоном аминоацил-тРНК, а белковыми факторами терминации. Эти белки способствуют гидролитическому отщеплению полипептида от конечной тРНК и его высвобождению, затем обеспечивают отделение о П-участка последней тРНК и приводят к диссоциации 70S-рибосомы на 30S- и 50S-субчастицы, готовые к синтезу новой полипептидной цепи.
Процессинг.
В определенный момент времени белок принимает свою нативную конформацию, то есть линейная и одномерная генетическая информация, содержавшаяся в мРНК, преобразуется в специфичускую трехмерную структуру новосинтезированного полипептида.Транскрипты РНК, синтезированные при помощи РНК-полимеразы, претерпевают дальнейшие ферментативные превращения, называемые посттранскрипционным процессингом, и только после этого они обретают свою функциональную активность. рРНК и тРНК синтезируются в виде более длинных предшественников, которые затем модифицируются и расщепляются с образованием конечных продуктов[7].