 |
|
Оптическая изомерия
Все a-аминокислоты, кроме глицина H2N-CH2-COOH, содержат асимметрический атом углерода (a-атом) и могут существовать в виде оптических изомеров (зеркальных антиподов).

4.Строение.
α-Аминокислоты содержат одновременно основную аминную и кислую карбоксильные группы. Поэтому они могут давать соли как с основаниями, так и с кислотами, т.е. являются амфотерными соединениями:
+
 Cl-[NH3CH2COOH] [H2NCH2COO-]Na+
Cl-[NH3CH2COOH] [H2NCH2COO-]Na+
хлоргидрат глицинанатриевая соль глицина
Водные растворы одноосновных моноаминокислот имеют почти нейтральную реакцию(РН=6,8).
Ряд фактов свидетельствует о солеобразном строении аминокислот. Так, например, известно, что слабо диссоциированные жирные кислоты в водных растворах обнаруживают характерную для недиссоциированной карбоксильной группы линию в ИК-спектре. Эта линия исчезает при добавлении к раствору сильной щелочи вследствие почти полной диссоциации образующейся соли. Первичные амины же в виде оснований обнаруживают в ИК-спектрах интенсивные линии. Оказалось, что в ИК-спектрах растворов аминокислот и те и другие линии отсутствуют.
При подкислении раствора аминокислоты появляется линия, соответствующая карбоксильной группе, а при подщелачивании – линия, характерная для аминогруппы.
На основании приведенных фактов следует признать, что в аминокислотах нет ни свободной аминогруппы, ни карбоксильной группы. Они представляют собой внутренние соли, у которых карбоксильная группа ионно связана с аммониевым атомом азота:
+
H3N-CH2COO-
В водных растворах молекулы аминокислот ведут себя как биполярные ионы:
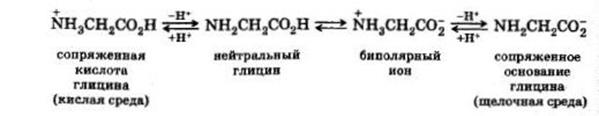
Под действием электрического тока они мигрируют к аноду или к катоду в зависимости от рН среды. Если этот процесс проводят на хроматографической бумаге или в гелях, то он называется электрофорезом. Этот метод часто применяют для идентификации и разделения аминокислот. В связи с тем, что в зависимости от строения молекулы могут преобладать либо кислотные свойства карбоксила, либо основные свойства аминогруппы, в водных растворах аминокислот рН среды отличается от 7. Но на кривой титрования аминокислоты имеется значение рН, при котором число групп NH3+ оказывается точно равным числу групп – COO- . Следовательно, при этом РН в условиях электрофореза переноса ионов происходить не будет. Такое значение рН называют изоэлектрической точкой.
5.Получение в лабораторных и промышленных условиях.
Действие аммиака на α-галогенкислоты. Подобно тому, как амины образуются при действии аммиака на галогенопроизводные углеводородов, аминокислоты могут быть получены действием аммиака на α-галогенкислоты:
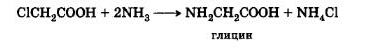
В настоящее время этот метод является основным промышленным методом синтеза α-аминокислот.
Циангидридный метод. α-аминокислоты получают действием аммиака на
α-оксинитрилы, которые при омылении дают соответствующие аминокислоты. Так как оксинитрилы получаются присоединением синильной кислоты к альдегидам и кетонам, эта реакция позволяет перейти от альдегидов и кетонов к аминокислотам (циангидридный синтез):

Как показал Н.Д. Зелинский, α-аминокислоты получаются сразу при действии на альдегиды и кетоны водного раствора цианида калия и хлорида аммония с последующим гидролизом. В результате обмена образуются хлорид калия и цианид аммония:

Цианид аммония, вступая в реакцию с альдегидом и кетоном, непосредственно образует аминонитрил.
Восстановление α-нитрокислот, оксимов или гидразонов α-оксокислот:

α-Аминокислоты получаются также при каталитическом восстановлении оксокарбоновых кислот водородом в присутствии аммиака:

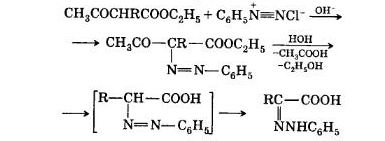
Метод В.В. Феофилактова. При действии на замещенные ацетоуксусные эфиры солей фенилдиазония в щелочной среде идет азосочетание, затем гидролиз, отщепляется уксусная кислота и образуется неустойчивое азосоединение, изомеризирующееся в фенилгидразон α-кетокислоты:
Восстановление фенилгидразона кетокислоты водородом в момент выделения (Zn+HСl) приводит к α-аминокислоте:
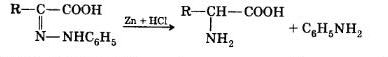
6.Физические свойства.
α-Аминокислоты представляют собой бесцветные кристаллические вещества. Большинство из них легко растворимо в воде. Многие α-аминокислоты обладают сладким вкусом, иногда с некоторым неприятным привкусом, у некоторых аминокислот горький вкус.
α-Аминокислоты плавятся с разложением при высоких и довольно близких температурах. Поэтому определение температуры плавления недостаточно для идентификации, и для этой цели обычно пользуются определением Rf аминокислоты с помощью бумажной хромотографии.
Солеобразный характер α-аминокислот проявляется и в их физических свойствах: аминокислоты обладают высокими температурами плавления, нелетучи, в большинстве своем они растворимы в воде и плохо или совсем нерастворимы в неполярных органических растворителях. Вследствие амфотерности аминокислот они способны нейтрализовать небольшие количества других кислот и оснований в водных растворах, и поэтому их растворы обладают буферными свойствами (сохраняют постоянные значения pH).
Производные α-аминокислот, которые не могут образовывать биполярные ионы (например, их эфиры H2NCH2COOC2H5 или ацетильные производные CH3CONHCH2COOH), растворимы в органических растворителях и могут перегоняться в вакууме без разложения.
Во всех (кроме глицина) природных α-аминокислотах имеются ассиметрические α-углеродные атомы:

Так же как для углеводов, буквы L и D обозначают принадлежность данной аминокислоты к L- или D- ряду, а знаки (+) и (-) указывают направление вращения. За исходное соединение, со строением которого принято сравнивать строение аминокислоты, условно принимают L- и D-молочные кислоты; конфигурации этих кислот в свою очередь установлены по L- и D- глицериновым альдегидам.
Аминокислоты, входящие в состав белков и большинства других природных соединений, относятся к L- отряду, D- формы аминокислот встречаются сравнительно редко. Они входят в состав лишь некоторых антибиотиков, например грамицидина-С.
Интересно отметить различие в физиологическом действии аминокислот L- и D- рядов. Большинство аминокислот L- ряда имеет сладкий вкус, а аминокислоты D- ряда – горькие или безвкусные.
Как правило, D- аминокислоты не усваиваются животными организмами. Синтетически полученные аминокислоты являются, естественно, рацематами. Для разделения их на оптические антиподы пользуются химическими, микробиологическими и главным образом ферментативными методами.
7. Химические свойства.
Подобно обычным карбоновым кислотам, аминокислоты вступают во многие реакции, свойственные соединениям, содержащим карбоксил. Они образуют соли, эфиры, амиды и галогенангидриды. При образовании эфиров, амидов и галогенангидридов кислот реагирует неионизированная карбоксильная группа, а потому с аминокислотами эти реакции идут труднее, чем с алифатическими кислотами. Наряду с этими реакциями для аминокислот характерны и реакции, свойственные аминам.