 |
|
В зависимости от окружения рК серина в белках изменяется чаще всего от 8,5 до 10
Что такое рК группы?
Значение рН среды, при которой группа протонируется на 50 %
Называется рК этой группы

От рК группы, работающей в катализе, зависит оптимум рН, при котором достигается максимальная скорость. Однако рК группы в составе фермента может изменяться в зависимости от окружения (набора аминокислот вблизи аминокислотного остатка, а также от общего электрического потенциала, создаваемого активным центром фермента)

Существуют ферменты, оптимум рН которых может лежать
От кислого (примерно 3) до щелочного опьтимума (до 9-10). Это зависит от функции фермента и места его локализации в организме (например ферменты желудка имеют кислый оптимум рН)
РК группы определяется относительной гидрофильностью, гидрофобностью, количеством и типом аминокислотных остатков вокруг аминокислотного остатка, принимающего участие в катализе
Например R-OH группа будет депротонироваться в гидрофобном окружении при рН около 9
Если же она контактирует с другими группами, например карбоксильной или другой ОН группой, то ее рК снизится примерно до 8

Чем больше гидрофильных групп взаимодействует с этой группой, тем меньше ее рК и тем при более низких-нейтральных рН она депротонируется.
РК каждой из групп имеет большое значение, поскольку в зависимости от того протонирована она или нет, она может выполнять совершенно различные функции
Рассмотрим это на примере остатка лизина

В белках рК e-амино-группы может быть от 9 до 11
Есть и аномальные значения рК
В ацетоацетатдекарбоксилазе рК равно 6,9
При щелочных рН e-амино-группа незаряжена и может выступать в качестве нуклеофила
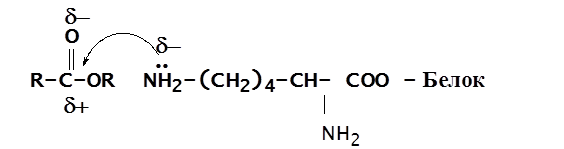
При нейтральных рН амино-группа заряжена и, в основном,
Может взаимодействовать электростатически с образованием контактов, фиксирующих субстрат в активном центре
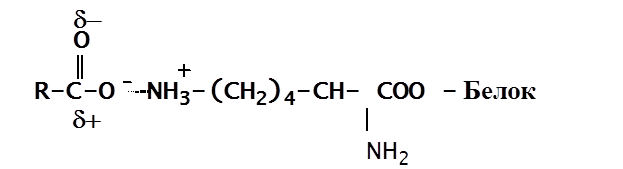
РК гуанидиниевой группы аргинина имеет очень высокое значение (приблизительно 12). Поэтому при нейтральных рН он обычно заряжен и чаще выступает в качестве группы, фиксирующей субстрат; в редких случаях выступать в качестве нуклеофила.

Тирозин может выступать как фиксирующая группа за счет образования водородной связи с ОН-группой, стекинг взаимодействий ароматических субстратов с бензольным кольцом и как нуклеофил.
Серин и треонин в белков и ферментов могут образовывать водородные связи и в этом случае выполняют роль "фиксаторов" определенных групп субстрата в активных центрах ферментов. С другой стороны, они могут выполнять роль сильных нуклеофильных групп в реакциях нуклеофильного замещения.
Серин

В зависимости от окружения рК серина в белках изменяется чаще всего от 8,5 до 10
Треонин
