 |
|
Промисловість реактивів і особливо чистих речовин. 4 страница
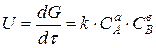 , (3.6)
, (3.6)
або
 .
.
Для гетерогенних процесів (при фазовому перетворенні речовини) рівняння масопередачі визначається аналогічно рівнянню Ньютона для теплопередачі
 , (3.7)
, (3.7)
де:  – сумарна швидкість процесу, визначена диференціалом збільшення кількості продукту dG за час dt; k – константа швидкості процесу, яка є функцією кількох чинників (насамперед температури), що впливають на процес; F – поверхня контакту реагуючих фаз; DС – рушійна сила процесу.
– сумарна швидкість процесу, визначена диференціалом збільшення кількості продукту dG за час dt; k – константа швидкості процесу, яка є функцією кількох чинників (насамперед температури), що впливають на процес; F – поверхня контакту реагуючих фаз; DС – рушійна сила процесу.
Константа, або коефіцієнт швидкості процесу k є складною величиною, що залежить від хімічних і фізичних властивостей реагуючих речовин, конструкції апарата, швидкостей потоків реагуючих мас або ступеня перемішування компонентів у гемогенномy середовищі. Для гомогенних процесів дифузія не відіграє важливої ролі. Перебіг процесу відбувається у кінетичній області. Для гетерогенних процесів дифузія у багатьох випадках насамперед обмежує швидкість процесу, тобто процес відбувається у дифузійній області.
Для підвищення швидкості процесу треба знайти способи збільшення визначальних величин – рушійної сили DС, константи швидкості реакції k та поверхні контактування реагуючих речовин F.
Збільшення рушійної сили DС процесу досягається збільшенням концентрації реагуючих компонентів у вихідних матеріалах (сировині), підвищенням тиску, відведенням продуктів реакції із зони реакції. Спосіб збільшення концентрації реагуючих компонентів у вихідній сировині залежить від агрегатного стану матеріалу і пов'язаний зі збагаченням сировини.
Важливим чинником, що впливає на швидкість реакції, є енергія активації молекул, тобто енергія, яку повинна мати молекула, щоб вступити в реакцію. Перебіг реакції буде тим інтенсивнішим, чим більшою буде концентрація молекул і чим меншою буде енергія їхньої активації.
Підвищення концентрації реагентів зумовлює не тільки прискорення реакції, а й зменшення об'єму апаратури, виробничих площ, економію транспорту, матеріалів і т. ін.
Підвищення тиску впливає як на швидкість процесу, так і на стан рівноваги. Найбільше спливає тиск на швидкість процесів, які відбуваються у газовій фазі або між газами і рідинами чи твердими тілами. Іноді підвищеним тиском користуються для затримання процесів розкладання вихідних речовин і виділення газоподібних продуктів реакції. З підвищенням тиску зростає коефіцієнт теплопередачі, тобто збільшується ступінь використання теплоти. В окремих випадках підвищення тиску призводить до зовсім інших наслідків реакції, як, наприклад, у процесах газифікації твердого палива.
Без застосування тиску деякі процеси хімічної технології взагалі не можна реалізувати, як, наприклад, синтез NH3, CH3OH, поліетилену, гідрування вугілля та ін. Застосування надвисокого тиску дає змогу здійснювати процеси без каталізаторів.
Кількісно вплив тиску визначається кінетичними рівняннями. Швидкість реакції у газовому стані пропорційна тиску у степені, що дорівнює порядку реакції. Найбільший вплив тиску на реакції високого порядку, але зі збільшенням тиску може змінюватись порядок реакції п і зменшуватись константа швидкості k. Кінетичне рівняння залежності швидкості реакції від тиску має такий вигляд:
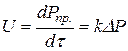
де: Рпр – парціальний тиск продукту у газовій суміші; DР – рушійна сила процесу. Для модельної реакції, якщо вона незворотна або перебіг її далекий від стану рівноваги,
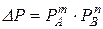 .
.
Для адсорбції, абсорбції, конденсації та інших процесів перетворення газоподібних компонентів у тверду або рідку фазу за аналогією з рівнянням (3.7) необхідна швидкість
 .
.
Якщо процес незворотний або далекий від рівноваги, то DР = Рг, де Рг – парціальний тиск компонента у газовій фазі.
Для процесів десорбції газів і випаровування рідин прискорення процесу і збільшення виходу досягається зниженням тиску, тобто застосуванням вакууму.
У твердофазних процесах, у зв'язку з незначною стисливістю твердих тіл, ефективними будуть тільки надвисокі тиски, які зумовлюють перебудову електронних оболонок атомів, деформацію молекул і зрушення фазової рівноваги. Таким шляхом з вуглецю, розчиненого у розплавлених металах, при надвисоких тисках до 1010 Па і температурах до 2400°С виробляють штучні алмази.
Найбільш ефективним засобом зміни константи швидкості реакції є зміна температурного режиму системи.
Температура є найсильнішим чинником прискорення реакції. Підвищення температури впливає на швидкість реакції і на рівновагу хіміко-технологічних процесів, що відбуваються як у кінетичній, так і у дифузійній області. Вплив температури на процеси, які відбуваються у кінетичній області, залежить від теплового ефекту реакції. Залежність швидкості хімічної реакції від температури характеризується температурним коефіцієнтом швидкості реакції, що є відношенням констант швидкості реакції при температурах, різниця між якими дорівнює 10° С
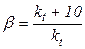
Практично при підвищенні температури на 10°С швидкість реакції збільшується приблизно в 2-4 рази. Чим більша енергія активації, тим вищий температурний коефіцієнт. Це не зовсім точне правило Вант-Гоффа справджується тільки для невеликого інтервалу температур (0-400 °С).
Найсильніше впливає підвищення температури на процеси, які пов'язані з ендотермічними зворотними реакціями, оскільки, згідно з принципом Ле-Шательє, при цьому збільшується рівноважний вихід і прискорюється реакція, тобто зменшується час для досягнення рівноваги.
Прикладом підвищення рівноважного виходу XР із зростанням температури може бути ендотермічна реакція синтезу NO з елементів N2+О2  2NO+Q.
2NO+Q.
Залежність рівноважної концентрації ХР від температури така:
| T, K | |||||
| ХP, об % | 0,37 | 0,59 | 0,98 | 2,31 | 3,50 |
Для більшості процесів, що відбуваються в кінетичній області, вплив температури реагуючих мас на константу швидкості реакції визначається рівнянням Арреніуса.
При підвищенні температури зворотні реакції інтенсифікуються внаслідок збільшення константи швидкості прямої реакції, тоді як рівновага екзотермічних реакцій зміщується у бік вихідних продуктів.
Екзотермічні зворотні реакції, які нині переважають у процесах хімічних виробництв, прискорюються при підвищенні температури тільки внаслідок збільшення константи швидкості прямої реакції (за формулою Арреніуса). Швидкість зворотної ендотермічної реакції при збільшенні температури, починаючи з деякої межі, зростає швидше, ніж прямої, внаслідок чого вихід продукту Х, підвищується із зростанням температури тільки до деякої межі (максимуму), що відповідає оптимальній температурі. При підвищенні температури вище оптимальної вихід продукту спадає так само, як і рівноважний. Такий вид залежності виходу продукту від температури характерний для багатьох виробничих зворотних реакцій – окиснення SО2 до SО3, окиснення NO до NO2, конверсії CO та ін.
Вплив температури на швидкість процесів у дифузійній області виявляється у збільшенні коефіцієнта дифузії D і відповідно коефіцієнта масопередачі k з підвищенням температури. Це видно з рівняння швидкості гетерогенного процесу (3.7) у дифузійній області, для якої k = f(D1,D2,…).
У зв'язку з тим, що температурний коефіцієнт швидкості реакції більший за температурний коефіцієнт дифузії, деякі хіміко-технологічні процеси (наприклад, газифікація палива, випалення сульфідних руд) при підвищенні температури переходять із кінетичної області у дифузійну.
Вплив температури на фазовий стан має велике значення для багатьох процесів хімічної технології. Високі температури іноді є єдиним засобом практичного здійснення багатьох "твердофазних" процесів. До таких процесів можна віднести спікання і сплавлення у виробництві в'яжучих матеріалів, кераміки, глинозему та ін. Велику роль у технології має перехід хоча б частини матеріалу у рідку або газову фазу, що різко збільшує швидкість дифузії і поверхню контакту фаз. Багато реакцій, які у рідкій фазі відбуваються у кілька стадій, вдалось здійснити безпосередньо у газовій стадії на твердих каталізаторах при високих температурах. Це – пряма гідратація етилену, пряме відновлення нітробензолу в анілін і т. д. Каталітичні реакції у газовому стані можна проводити безперервно, циклічно, з мінімальними витратами і з повною автоматизацією процесів.
Хоч підвищення температури позитивно позначається на хіміко-технологічному процесі, застосування високих температур для його інтенсифікації часто обмежується різними технологічними і економічними чинниками: швидким досягненням рівноваги екзотермічних реакцій, матеріалами апаратури і економічно невигідними витратами енергії для нагрівання реагуючих компонентів.
Швидкість гетерогенного процесу пропорційна питомій поверхні дотику фаз
U = kFDC,
де: U – швидкість реакції; F – питома поверхня; k – коефіцієнт масопередачі; DC – рушійна сила процесу.
Питання до розділу 3
1. Яка різниця між хімічними та хіміко-технологічними процесами?
2. З яких стадій складається ХТП? Дайте характеристику кожної з них.
3. Як класифікують хімічні реакції?
4. Що називають технологічним режимом і якими параметрами він характеризується?
5. Які процеси називають гомогенними, а які гетерогенними?
6. Які процеси називають каталітичними і некаталітичними, екзотермічними і ендотермічними?
7. Дайте визначення основних показників ефективності ХТП: ступінь перетворення, вихід продукту, селективність.
8. Які висновки можна зробити на основі термодинамічних розрахунків?

Розділ 4. ХІМІЧНІ РЕАКТОРИ
Хімічним реактором (ХР) називають апарат, в якому здійснюють хіміко-технологічний процес (хімічну реакцію з масообміном). Крім основного апарата (реактора) в ХР використовуються допоміжні апарати, в яких здійснюються підготовчі операції: подрібнення, розчинення, осушування або зволоження, нагрівання або охолодження, промивання і т. ін. Ці апарати розташовуються у технологічній схемі до реактора. Основне призначення апаратів, які розташовані за реактором – розділення продуктів реакції, їх концентрування або очищення від домішок.
Іноді і допоміжні операції, і сама реакція можуть відбуватися в одному апараті.
Вимоги до ХР:
· забезпечувати найбільшу продуктивність і інтенсивність;
· забезпечувати високий ступінь перетворення при max селективності процесу;
· мати малі енергетичні затрати на транспортування і перемішування реагентів;
· бути достатньо простими за будовою і дешевими;
· найбільш повно використовувати теплоту екзотермічних реакцій і зовнішню теплоту, яка підводиться для здійснення ендотермічних реакцій;
· бути надійними у роботі, легко піддаватися механізації та автоматизації.
Продуктивність реактора визначають за формулою:
 ,
,
де: G – маса продукту реакції, кг; t – час роботи реактора, год.
4.1. Класифікація хімічних реакторів
За конструкцією хімічні реактори дуже різні. Однак для всіх реакторів є загальні характеристики їх функціонування. До них належать:
· спосіб підведення реагентів і відведення продуктів реакції;
· режим руху і перемішування реагентів у реакторі;
· умови теплообміну і температурний режим в апараті;
· фазовий склад реагентів і продуктів реакції.
До найбільш важливих характеристик будь-якого реактора належать перші три характеристики.
Спосіб підведення і відведення реагентів може здійснюватися періодично, безперервно або напівбезперервно (напівперіодично). Відповідно ХР поділяють на:
· реактори періодичної дії;
· реактори безперервної дії (проточні);
· реактори напівбезперервної дії.
Реактори періодичної дії.У таких реакторах реагенти завантажують на початку операції. Після певного часу, необхідного для досягнення заданого ступеня перетворення, апарат розвантажують. Основні параметри процесу: концентрація реагентів і продуктів реакції, температура, тиск і т. ін. – змінюються у часі. Середню швидкість процесу можна визначити через продуктивність реактора. Реальна швидкість сильно і нелінійно змінюється протягом роботи реактора, по-перше, внаслідок зменшення концентрації вихідних реагентів (за логарифмічним законом) і по-друге, внаслідок неізотермічності процесу (підвищення температури на початку процесу і пониження у кінці). Реактори періодичної дії працюють, як правило, при сильному перемішуванні реагентів, близькому до повного змішування і, відповідно, при однаковій температурі у всьому реакційному об'ємі.
Реактори безперервної дії(проточні) працюють при постійній подачі реагентів і виведенні продуктів реакції. Важливою характеристикою цих реакторів є об'ємна швидкість v, яку можна визначати як відношення об'єму речовини Vр, яка надходить за час t до корисного реакційного об'єму V:
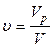 .
.
Таким чином, об'ємна швидкість характеризує продуктивність безперервно діючого апарата (рис. 4.1).

Рис. 4.1. Залежність виходу продукту X, опору апарата DР ійого
інтенсивності I від об'ємної швидкості v
Зі зростанням об'ємної швидкості продуктивність (інтенсивність) реактора підвищується, однак при цьому спадає ступінь перетворення (вихід продукту) і зростає опір руху реагентів через апарат. Тому об'ємну швидкість доцільно збільшувати до якогось певного значення, зумовленого економічними показниками.
Реактори напівбезперервної діїхарактерні тим, що сировина надходить в апарат безперервно або певними порціями через однакові проміжки часу, а продукти реакції виводяться періодично. Можливе і безперервне виведення продуктів реакції при періодичній подачі сировини. Такі реактори працюють у перехідному режимі, основні параметри процесу змінюються у часі.
4.2. Режим руху і перемішування реагентів
Розрізняють два види перемішування реагентів у потоці, який проходить через реактор – поздовжнє (основне) і радіальне. За режимом руху і перемішування реагентів розрізняють два типи реакторів безперервної дії: ідеального витіснення і ідеального змішування.

Рис. 4.2. Зміна концентрації реагентів (а), ступеня перетворення (б) і швидкості реакції (в) в реакторі ідеального витіснення
Реактор ідеального і витісненняхарактеризується тим,що реагенти послідовно шар за шаром без перемішування ламінарним потоком проходять весь реакційний шлях, який визначаєтеся довжиною (висотою) апарата. У реакторі ідеального витіснення перемішування немає. По довжині (висоті) реактора зменшується концентрація реагентів (С) і швидкість реакції (U), а вихід продукту збільшується (рис. 4.2).

| |
| Рис. 4.3. Реактор ідеального витіснення – контактний апарат для ендотермічних реакцій з каталізатором у трубках | Рис. 4.4. Реактор ідеального витіснення – порожниста окислювальна колона з перегородками |
Прикладами апаратів ідеального витіснення можуть бути контактні апарати з каталізатором у трубах (рис. 4.3), шахтні печі, плівкові абсорбери, пустотілі реактори для гомогенних процесів у газовій фазі, зокрема колони для окиснення NO в NО2 (рис. 4.4), також колони з насадками і зрошуванням рідиною, коли висота колони велика (10-20 м), швидкість газу невелика і густина зрошування (витрата рідини на одиницю площі перерізу колони) теж невелика.
Реактори повного змішуванняхарактеризуються тим, що частинки реагента (йон, молекула, частинка твердої речовини) завдяки інтенсивному перемішуванню миттєво і рівномірно розподіляються в об'ємі реактора. У реакторах повного змішування будь-який елементарний об'єм миттєво змішується з реакційним вмістом реактора, оскільки швидкість циркуляційних потоків по висоті і поперечному перерізу апарата багато разів більша від лінійної швидкості переміщення по осі реактора. Фізичною моделлю реактора повного змішування може служити змішувач з пропелерною мішалкою, або іншою інтенсивною мішалкою (рис. 4.5).

| 
|
| Рис. 4.5. Реактор повного змішування – змішувач з пропелерною мішалкою | Рис. 4.6. Зміна концентрації (а), ступеня перетворення (б) і швидкості перетворення (в) у реакторі повного перемішування |
Зміна концентрації реагентів, ступеня перетворення і швидкості перетворення по об'єму реактора повного перемішування описуються залежностями, показаними на рис. 4.6, характер яких повністю відповідає фізичній моделі реактора.
За типом реакторів повного змішування у системі Г–Р, Р – Т, Г–Р – Т працюють змішувачі з механічними (рис. 4.5), пневматичними і струменевими змішувальними пристроями, пінні апарати і реактори з розбризкуванням рідини за рахунок кінетичної енергії потоку газу (зокрема, абсорбери Вентурі, рис. 4.7).
Збільшення кількості обертів п змішувального пристрою (або швидкості потоку газу і рідини) забезпечує, з одного боку, найбільше наближення апарата до реактора повного змішування, а з другого – до росту швидкості процесу до певної границі (рис. 4.8), після досягнення якої швидкість перетворення u може зменшуватися.

| |
| Рис. 4.7. Реактор повного змішування – абсорбер Вентурі: 1 – сопло; 2 – горловина; 3 – камера змішування; 4 – камера розділення | Рис. 4.8. Залежність швидкості процесу U від кількості обертів мішалки n у реакторі розділення повного змішування |
В системі Г–Т до типу повного змішування наближений режим апаратів з киплячим шаром (КШ) зернистого матеріалу, особливо апаратів з мішалками (рис. 4.9), близький до режиму повного змішування апаратів циклічного типу, які застосовуються для спалювання сірки і обпалювання сульфідних руд.
 Рис. 4.9. Реактор повного змішування – апарат КШ з мішалкою
Рис. 4.9. Реактор повного змішування – апарат КШ з мішалкою
|  Рис. 4.10. Каскад реакторів змішування: а – принципова схема; б – зміна концентрації вихідної речовини по ступенях каскаду (1) і середня (2)
Рис. 4.10. Каскад реакторів змішування: а – принципова схема; б – зміна концентрації вихідної речовини по ступенях каскаду (1) і середня (2)
|
Каскад реакторів повного змішування.Їх використовують для досягнення високого виходу продукту, оскільки в одному реакторі при великих ступенях перетворення рушійна сила процесу наближається до нуля і його швидкість виявляється дуже низькою. У каскаді реакторів повного змішування з порівняно невеликим ступенем перетворення у кожному ступені (рис. 4.10) склад реакційної суміші змінюється при переході з одного апарата в другий. Розрахунок каскаду реакторів здійснюється шляхом сумування всіх змін, які відбуваються у кожному ступені каскаду.
При кількості реакторів більше 4 зміна рушійної сили процесу у каскаді реакторів змішування наближається до режиму ідеального витіснення.
За температурним режимомреактори поділяються на: адіабатичні; ізотермічні; політермічні.
Адіабатичні реактори –ті, які не мають теплообміну з навколишнім середовищем, тобто мають добру теплоізоляцію. Вся теплота реакції акумулюється потоком реагуючих речовин.
Ізотермічні реактори –ті, які мають постійну температуру у всіх точках реакційного об'єму, тобто tк = tcep. у часі і просторі. Способи досягнення ізотермічності:
· за допомогою теплообмінників, розміщених у реакційному об'ємі (для підведення теплоти в ендотермічних реакціях і відведення теплоти в екзотермічних реакціях);
· теплообміну через стінку реактора (реактор з подвійною стінкою);
· введенням у реакційну зону холодного або нагрітого потоку реагенту;
· за допомогою інтенсивного перемішування реагентів в апараті з мішалкою і у реакторах з киплячим шаром.
Ізотермічний режим спостерігається у реакторах з малою концентрацією вихідних речовин і у реакціях з малим тепловим ефектом. В окремих випадках ізотермічність у реакторі досягається за рахунок теплової рівноваги екзо- і ендотермічної реакції випаровуванням розчинника (води).
Політермічні реактори –в яких теплота реакції тільки частково компенсується за рахунок відведення (підведення) теплоти. До політермічних апаратів належать реактори з малим ступенем змішування речовин і теплообмінниками, розміщеними всередині реакційного об'єму, наприклад трубчасті контактні апарати. Температура по висоті Н таких апаратів при здійсненні екзотермічних процесів змінюється по характерній кривій (рис. 4.11). Політермічність можна забезпечити, використовуючи каскад реакторів (КРІЗ або КРІВ), у кожному з яких можна встановлювати задану температуру. Приклад політермічного каскаду реакторів ідеального витіснення наведено на рис. 4.12.

Рис. 4.11. Зміна температури залежно від висоти (Н) політермічного реактора

Рис. 4.12. Політермічний каскад реакторів ідеального витіснення
Питання до розділу 4
1. Що називають хімічним реактором?
2. Основні вимоги до хімічних реакторів.
3. Навести загальні характеристики функціонування хімічних реакторів.
4. Які є типи реакторів? Навести характеристику кожного з них.
5. Як класифікують реактори за режимом руху і перемішування реагентів?
6. Навести приклад реактора ідеального витіснення.
7. Дати характеристику реактора повного змішування.
8. Для чого використовують каскад реакторів повного перемішування?
9. Як поділяють реактори за температурним режимом? Навести їх характеристику.

Розділ 5. ГОМОГЕННІ ХІМІКО-
ТЕХНОЛОГІЧНІ ПРОЦЕСИ І РЕАКТОРИ
Гомогенниминазивають хімічні процеси, які проходять в однорідному, тобто у рідкому або газоподібному середовищі.
Гетерогенниминазивають ХТП, в яких реагенти знаходяться у різних фазах і реакція відбувається на поверхні розділу фаз.
5.1. Гомогенні процеси у газовій фазі
Гомогенні процеси у газовій фазі особливо характерні для технології органічних речовин і реалізуються в основному випаровуванням органічних речовин з подальшою обробкою парів газоподібними реагентами – хлором, киснем, двооксидом сірки, оксидами азоту. Відповідно відбуваються хімічні реакції хлорування, окиснення, сульфування, нітрування і т.д. Часто застосовують парофазний піроліз, тобто нагрів органічних речовин без доступу повітря з метою отримання нових продуктів. При піролізі відбувається розклад складних молекул з утворенням вільних радикалів, насичених і ненасичених вуглеводнів, які вступають у реакції полімеризації, конденсації, ізомерації і ін. Піроліз рідких і газоподібних речовин називається також крекінгом.
У технології неорганічних речовин газофазні гомогенні процеси здійснюються, наприклад, при виробництві сульфатної, нітратної і хлоридної кислот. Так, у пароподібному стані спалюють сірку у печах камерного типу для отримання SO2; отримують оксид азоту з повітря в умовах низькотемпературної плазми (103‑105 К) за реакцією:
N2 + O2 = 2NO DН = –179,2 кДж.
В низькотемпературній плазмі здійснюється також електрокрекінг вуглеводнів, наприклад метану, з метою отримання ацетилену, синтез озону з кисню і ін.
У виробництві нітратної кислоти у газовій фазі відбувається окиснення оксиду азоту до двооксиду за рівнянням
2NO + О2 = 2NО2 DН = –119,3 кДж.
В газовій фазі відбувається синтез хлористого водню з водню і хлору у виробництві хлоридної кислоти за реакцією
Н2 + С12 = 2НСІ.
5.2. Гомогенні процеси у рідкій фазі
Гомогенні процеси у рідкій фазі застосовують у промисловості частіше, ніж газофазні. Швидкість хімічних реакцій у рідкій фазі, як правило, у тисячі разів більша, ніж у газах (при цій же температурі), зате швидкість дифузії у рідинах значно менша, ніж у газах, внаслідок великої в'язкості рідини. Коефіцієнт дифузії у газах становить 0.1-1.0 см2/с, а у рідинах 10-4–10-5 см2/с.
До гомогенних процесів у рідкій фазі належать, наприклад, реакції нейтралізації і обмінного розкладу у технології мінеральних солей. У рідкій фазі здійснюється ряд процесів у технології органічних речовин:
· отримання простих і складних ефірів;
· полімеризація у розчинах і розплавах;
· лужне плавлення бензолсульфокислот у виробництві фенолу;
· окремі стадії сульфатнокислотної гідратації у виробництві етилового спирту і ін.
В гомогенних середовищах – газовому і рідкому – багато процесів відбувається за ланцюговим механізмом: окиснення, полімеризація і піроліз вуглеводнів, галогенування вуглеводнів, синтез хлороводню і ін.
На швидкість гомогенних процесів у газовій і рідкій фазах впливають концентрації реагуючих речовин, тиск, температура і перемішування.
Більшість реакцій проходять (відбуваються) у кілька стадій. Швидкість всієї реакції лімітується швидкістю найповільнішої стадії, яка і визначає порядок реакції. Тому, як правило, порядок реакції не співпадає з її молекулярністю, тобто сумою молекул, які взаємодіють за стехіометричними рівнями реакції. Наприклад, розклад пероксиду водню за схемою
2Н2О2 ® 2Н,О + О2
повинен би відбуватися як реакція другого порядку. Насправді ж порядок цієї реакції залежить від умов її проведення. Тому прийнято розрізняти порядок реакції і її молекулярність.
Порядок реакції –це сума показників степенів при концентраціях реагуючих речовин у кінетичному рівнянні.
За порядкомреакції поділяють на нульового, першого, другого, третього і дробового порядку.
За молекулярністюреакції поділяють на моно-, бі- і тримолекулярні (одночасне зіткнення більше трьох молекул ймовірно неможливе).
До мономолекулярнихналежать реакції внутрімолекулярних перегрупувань (ізомеризація, інверсія) і реакції розкладу A®D+R. Наприклад, при піролізі вуглеводнів мономолекулярні реакції утворення ненасичених сполук такі:
С2Н6 = С2Н4 + Н2,
С3Н8 = С3Н6 + Н2 і т.д.
Бімолекулярні реакціїподіляються на реакції:
· приєднання А + А ® АА або А + В ® АВ, наприклад С2Н4 + Н2 = С2Н6;
· розкладу 2А ® D +R, наприклад 2Н2О2 = 2Н2О + О2;
· заміщення (обміну) А + ВС ® АВ + С або АВ + CD ® АС + BD, наприклад
Zn + CuSО4 = ZnSО4 + Cu.
Тримолекулярні реакції,при яких взаємодіють три молекули, трапляються рідко; як правило вони відбуваються послідовно (по-стадійно). Тримолекулярними можуть бути реакції приєднання 3А ® D; 2A + В ® D, обміну A + B + C ® D + R +...
5.3. Вплив концентрації реагуючих речовин, тиску, температури, переміщування на швидкість гомогенних реакцій
Вплив концентрації реагуючих речовин.На швидкість хімічних реакцій вплив концентрації описується рівнянням
U = kDC,
При цьому U може бути виражено через зміну маси продукту в одиниці реакційного об'єму
 ,
,