 |
|
Промисловість реактивів і особливо чистих речовин. 5 страница
або зміни концентрації
 ,
,
або зміни ступеня перетворення
 .
.
З точки зору хімічної кінетики реакції поділяють на прості і складні.
Прості реакції,як правило, проходять в одну стадію. Порядок таких реакцій співпадає зі стехіометричними коефіцієнтами рівняння реакції. У загальному вигляді кінетичне рівняння простої незворотної реакції
аА + вВ ® продукти
згідно з законом діючих мас має вигляд
 .
.
Залежність ступеня перетворення Х і непрореагованого залишку речовини (1–X) від часу наведено на рис. 5.1.
Складні реакціїпроходять, як правило, у кілька стадій серед яких можуть бути і зворотні. Кінетичне рівняння зворотної реакції першого порядку має такий вигляд
 .
.
В момент рівноваги  , тому k1(1 – Х) – k2X = 0, звідси константа рівноваги
, тому k1(1 – Х) – k2X = 0, звідси константа рівноваги  .
.
Швидкість зворотної реакції другого порядку має такий вигляд:
 .
.
Швидкість реакції третього порядку має такий вигляд:
 .
.
Реакції третього порядку внаслідок невеликої швидкості мають обмежене практичне застосування.
Щоб визначити константу швидкості, необхідно визначити ступінь перетворення речовини X через певний проміжок часу t і навпаки, знаючи k, можна встановити ступінь перетворення речовини у будь-який момент часу.
Вплив тиску.Підвищення тиску прискорює газові реакції аналогічно підвищенню концентрації реагентів, оскільки з підвищенням тиску збільшується концентрація реагуючих речовин. Якщо при атмосферному тиску рушійна сила процесу DС, то при тиску Р
DСP = DС× 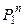 ,
,
де: P1 – величина, яка дорівнює відношенню застосованого тиску до атмосферного (безрозмірна величина); п – порядок реакції.
Вихід продукту газової реакції синтезу збільшується з підвищенням тиску (рис. 5.2).

| 
|
| Рис. 5.1. Залежність виходу продукту X і кількості непрореагованої речовини (1–Х) від часу для необоротної реакції | Рис. 5.2. Залежність виходу продукту газової реакції синтезу від тиску (t, C, t = Const) |
Вплив температури.Підвищення температури викликає прискорення гомогенних реакцій згідно з рівнянням Арреніуса:
 .
.
Дане рівняння називають кінетичною моделлю процесу. При підвищенні температури прискорюються і дифузійні процеси. Однак підвищення температури обмежується умовами рівноваги, появою побічних реакцій і іншими причинами. Для всіх процесів намагаються встановити оптимальну температуру, при якій затрати на нагрівання покриваються (окуповуюються) прискоренням процесу.
Вплив перемішування.Перемішування має найбільше значення для рідинних процесів, оскільки швидкість дифузії у рідинах у десятки і сотні тисяч разів менша, ніж у газах. Перемішування розчинів дає змогу суттєво збільшити загальну швидкість процесу. Для газових реакцій перемішування необхідне, по-перше, для початкового змішування компонентів, по-друге, для вирівнювання концентрації і температур у ході процесу. Початкове змішування здійснюють за допомогою різних форсунок, через які підводять гази з таким розрахунком, щоб вони змішалися у загальному турбулентному потоці.
5.4. Реактори для гомогенних процесів
Гомогенні реактори у більшості випадків є типовою апаратурою. Основні типи гомогенних реакторів наведені на рис. 5.3.

Рис. 5.3. Типи реакторів для гомогенних процесів газофазних (а-д) і рідиннофазних (д‑з): а, б – камерні реактори з пальниками; в – камерний реактор з інтенсивним перемішуванням, ізотермічний; г, д – трубчасті реактори витіснення, політермічного режиму; е, з –реактори з мішалками, режим повного змішування
Газофазні процесипроводять, як правило, у камерних і трубчастих реакторах. Часто використовують полум'яні реактори – пальники і камери згоряння, в яких для змішування газових реагентів є спеціальні пристрої – сопло, ежектор, центробіжний змішувач і ін. Камерні реактори використовуються для синтезу хлороводню (рис. 5.3,а), для спалювання сірки, термічного хлорування метану (рис. 5.3,б), термоокислювального піролізу метану і ін. За гідродинамічним режимом деякі камерні реактори, наприклад, з відцентровим змішувачем (рис. 5.3,в), наближаються до повного змішування, а деякі – до ідеального витіснення (рис. 5.3,а). Камерні реактори футеровані кислотостійким і температуростійким матеріалом; пальники виготовлені з легованих сталей або спеціальних металів (наприклад, тантал для синтезу НС1). Трубчасті реакторивиготовляють у вигляді газових теплообмінників (рис. 5.3,г), або охолоджувальних реакторів типу труба у трубі (рис. 5.3,д) і працюють у режимі ідеального витіснення.
Для проведення рідиннофазних процесів найбільш характерні реактори з різними перемішувальними пристроями. Періодичні процеси здійснюють в апаратах з механічними мішалками (рис. 5.3,е) або в автоклавах. Для безперервних рідиннофазних процесів застосовують проточні реактори – одиночні з перемішуванням (рис. 5.3,ж), каскад реакторів з мішалками (рис. 5.3,з), а також реактори витіснення такі ж, як і для газофазних процесів (рис. 5.3,д). Рідиннофазні гомогенні реактори застосовують для реакцій обміну у розчинах (наприклад, нейтралізації, етерифікації, диазотування, полімеризації, полі конденсації та ін.).
Питання до розділу 5
1. Навести приклади гомогенних процесів у газовій фазі.
2. Навести приклади гомогенних процесів у рідкій фазі.
3. Яка різниця між порядком і молекулярністю реакцій?
4. Які чинники впливають на швидкість гомогенного процесу? Описати їх вплив.
5. В яких реакторах проводять газофазні процеси, а в яких рідиннофазні?

Розділ 6. ГЕТЕРОГЕННІ (нЕКаТаЛіТиЧнІ) ХІміко-ТЕХНОЛОгіЧНІ ПРОЦЕСИ
Гетерогенні процеси характеризуються наявністю двох і більше взаємодіючих фаз, тому вони відбуваються з перенесенням речовини через поверхню розділу фаз. При цьому міжфазне масоперенесення може бути або самостійним процесом, або супроводжуватися хімічним перетворенням взаємодіючих компонентів. У першому випадку проходять суто фізичні або фізико-хімічні зміни, такі як абсорбція, адсорбція, десорбція, кристалізація, випаровування, плавлення і т. ін., а у другому – хімічні реакції, ускладнені масообміном. Самі собою хімічні реакції можуть проходити гомогенно всередині одної з фаз. На границі розділу фаз проходять реакції між компонентами, один з яких знаходиться у твердій фазі, а інший у газовій, рідкій або твердій.
6.1. Рівновага і швидкість гетерогенних процесів
Рівновага і швидкість гетерогенних процесів є функцією багатьох змінних і тому кількісна оцінка гетерогенних процесів досить складна. Для спрощення процес розглядають постадійно. Визначають найбільш повільну (лімітуючу) стадію (дифузія або хімічна реакція) і, описавши її математично, описують тим самим процес у цілому. Такий підхід виправданий, якщо швидкості дифузії і хімічного перетворення дуже різні. В іншому випадку приходиться враховувати обидва чинники і кінетичне рівняння дуже ускладнюється.
Рівновага у гетерогенниххімічних процесах, як і у гомогенних, визначає вихід готового продукту. На гетерогенну рівновагу впливає температура, тиск, концентрація реагуючих речовин і т. ін. Рівновага фаз визначається правилом фаз.
Для визначення фазової рівноваги у системі рідина-тверда речовина (Р – Т) застосовують діаграми фазового стану, в яких одну з властивостей системи визначають як функцію складу за дослідними даними. Аналіз діаграм фазового стану дає змогу визначити рівноважний вихід і умови проведення процесу.
Швидкість гетерогенних ХТПпри ідеальному витісненні і неповному перемішуванні виражається рівнянням
 .
.
При режимах, близьких до повного змішування,
 ,
,
де: DСk – кінцева рушійна сила процесу; k – коефіцієнт масопередачі; F – площа поверхні розділу фаз; G – маса продукту реакції.
Для процесів у дифузійній області збільшення коефіцієнта масопередачі k досягається, головним чином, збільшенням турбулентності взаємодіючих фаз, за рахунок чого постійно поновлюється міжфазна поверхня. При переході реакції у кінетичну область турбулізація негативно впливає на ефективність роботи реактора.
Збільшення рушійної силигетерогенного процесу досягається підвищенням концентрації реагуючих речовин, застосуванням оптимальних температур і тиску та ін. Збільшення міжфазної поверхні здійснюється вдосконаленням конструкції реакторів і застосуванням інтенсивного гідродинамічного режиму.
Кінетика гетерогенних процесів, конструкція реакторів і методи їх розрахунку, шляхи інтенсифікації процесів визначаються перш за все фазовим станом взаємодіючих реагентів і продуктів реакції. Тому нижче розглянуто процеси і реактори для основних видів двохфазних гетерогенних систем, які найбільше застосовуються у хімічних виробництвах.
6.2. Процеси і реактори у системі газ-рідина (Г–Р)
Процеси з участю рідких і газоподібних реагентів широко застосовуються у хімічній промисловості. До них належать абсорбція і десорбція газів, випаровування і конденсація парів, дистиляція і ректифікація рідких сумішей, піроліз рідин, полімеризація у газовій фазі з утворенням рідких полімерів і т.д. Для системи Г–Р особливо характерні абсорбційно-десорбційні процеси.
Абсорбція –процес поглинання газів рідинами з утворенням розчинів. Якщо абсорбція супроводжується хімічною реакцією, вона називається хемосорбцією. Сорбційні процеси широко розповсюджені у хімічній технології і є складовою частиною виробництв хлоридної, сульфатної, нітратної, фосфатної і інших кислот, амоніаку, соди, вони застосовуються для поглинання компонентів коксового газу, газів нафтопереробки і піролізу речовини, при очистках викидних газів, у технології органічного синтезу і т. ін.
Десорбція –процес, обернений абсорбції – полягає у виділенні з рідини розчинених у ній газів. На практиці десорбцію називають відгонкою і здійснюють нагріванням рідини і пропусканням через неї інертного газу або водяної пари. Виділення газоподібного компоненту з розчину відбувається завдяки зменшенню парціального тиску десорбованої речовини у газовому потоці. Десорбція використовується майже так часто, як абсорбція, оскільки сорбційні процеси комбінують: спочатку абсорбують потрібний компонент, а потім його десорбують у концентрованому вигляді. Саме таким способом у промисловості здійснюють виділення бензолу і його гомологів з коксового газу.
Рівновага у системі Г–Р,як і для інших гетерогенних систем, визначається з допомогою правила фаз, закону розподілу і константи рівноваги хімічних реакцій у рідкій фазі.
При розрахунку абсорбційної (десорбційної) рівноваги виражають склад рідини і газу у відносних молярних концентраціях і тоді
 ,
,
де:  – відносний молярний склад газу у стані рівноваги;
– відносний молярний склад газу у стані рівноваги;  – відносний молярний склад рідини;
– відносний молярний склад рідини;  – коефіцієнт розподілу.
– коефіцієнт розподілу.
Для хемосорбційних процесів рівновага характерна участю константи рівноваги хімічної реакції. Якщо у рідкій фазі відбувається зворотна реакція між абсорбованою речовиною А і поглинаючою речовиною В з утворенням продукту D (аА + bВ  dD) і система підпорядковується закону Генрі, то константу фазової рівноваги
dD) і система підпорядковується закону Генрі, то константу фазової рівноваги  можна визначити за формулою
можна визначити за формулою
 ,
,
де: Кс – константа рівноваги хімічної реакції; Сb – концентрація поглинаючої речовини (активної речовини поглинача).
Ступінь абсорбціїh – основний технологічний показник, який характеризує і швидкість процесів у системі Г–Р. Фактично ступінь абсорбції h рівнозначний виходу продукту X. Для абсорбції hє відношення кількості поглиненої речовини до рівноважної
 ,
,
де: Сгп і Сгк – концентрація речовини у газі, який відповідно надходить у реактор і виходить з нього;  – концентрація речовини у газі, рівноважна з середньоарифметичною концентрацією її у рідині.
– концентрація речовини у газі, рівноважна з середньоарифметичною концентрацією її у рідині.
При абсорбції рівновагу можна змістити у бік збільшення розчинності газу, зменшуючи температуру, збільшуючи початкову концентрацію речовини, яка поглинається Сгп або загальний тиск Р, що також збільшує Сгп. Для пониження температури охолоджують вихідні газ і рідину, відводять теплоту абсорбції з допомогою внутрішніх або зовнішніх теплообмінників. При десорбції газів і рідин рівновагу зміщують протилежними способами, тобто підвищенням температури і пониженням тиску; для цього обігрівають десорбер з допомогою теплообмінників або гострої пари.
Швидкість процесів у системі Г–Ррозглянемо на прикладі процесів абсорбції і десорбції. Для дифузійної області загальні кінетичні рівняння мають вигляд
U = KгF(P – Р*) або U = KpF(C* – С),
де: Р і Р* – парціальний тиск речовини, яка поглинається, фактичний і рівноважний; С і С* – концентрація розчиненої речовини у рідині фактична і рівноважна з газом; Кг і Кр – коефіцієнти масопередачі, виражені в одиницях парціального тиску або концентрації рідини; F – площа перерізу реактора або об'єм рідкої фази (поверхня розділу фаз).
Реакція у рідкій фазіпонижує концентрацію речовини, яка поглинається у рідині, тобто збільшує рушійну силу і швидкість процесу порівняно з фізичною абсорбцією.
Реактори для гетерогенних перетворень у системі Г–Р.Такі реактори є типовою хімічною апаратурою, в якій на хімічних заводах здійснюють як фізичні процеси (випаровування, дистиляцію і ректифікацію, промивання газів), так і хемосорбційні процеси (у виробництві кислот, соди, органічних речовин). Основні типи реакторів для взаємодії між рідинами і газами показані на рис. 6.1.

Рис. 6.1. Типи реакторів для гетерогенних процесів у системі Г–Р:
а, б – колони плівкові (а – з насадкою, б – трубчаста); в, г – колони барботажні
(в – з ситоподібними тарілками, г – з ковпачковими тарілками); д, е – колонні реактори з розбризкуванням рідини (д – пустотілий, е – циклонний); ж – реактор з розпилюванням рідини; з, й – пінні реактори; Г – газ; Р – рідина
Основне завдання конструктивного оформлення реакторів – збільшення поверхні контакту газової і рідкої фази. Це досягається в основному збільшенням поверхні рідкої фази.
Колона з насадкоює плівковим реактором (рис. 6.2).
Рідина розподіляється по поверхні насадки тонкою плівкою і стікає вниз назустріч газу. Реактор складається з колони, колосникової решітки, яка підтримує насадку, самої насадки і зрошувального пристрою. Насадка повинна мати велику питому поверхню, великий вільний об'єм, бути легкою, механічно міцною і дешевою. Крім того, насадка повинна чинити мінімальний опір потокові газу і добре змочуватися рідиною. Застосовуються насадки різної форми: кільця зі сталі або кераміки з однаковими розмірами висоти і діаметра (h´d=100´100 або 50´50 або 25´25 мм). Для інтенсифікації роботи реактора збільшують швидкості потоків газу і рідини.
Колони з насадкою – найбільш поширені реактори для абсорбційно-десорбційних процесів, їх широко застосовують у виробництві сульфатної, нітратної кислот, при переробці коксового газу, у ряді виробництв органічного синтезу і т. ін.
Барботажний реактор(рис. 6.3) може мати від однієї до декількох десятків ковпачкових або ситоподібних тарілок залежно від характеру процесу селективності. На кожній тарілці відбувається диспергування газу в об'ємі рідини шляхом барботажу, тобто пропусканням бульбашок газу через шар рідини, яка протікає по тарілці. Барботажні реактори також широко застосовуються у хімічній технології при концентруванні кислот у виробництві соди, при переробці нафти, для процесів дистиляції і ректифікації, у технології органічних речовин. Ці реактори конструктивно більш складні, ніж колони з насадкою, їх експлуатація пов'язана з великими затратами, але вони працюють більш інтенсивно, забезпечують високий ступінь розділення рідких сумішей.
 Рис. 6.2. Колона з насадкою: 1 – корпус; 2 – розбризкувач рідини; 3 – колосникова решітка; 4 – насадка (кільця)
Рис. 6.2. Колона з насадкою: 1 – корпус; 2 – розбризкувач рідини; 3 – колосникова решітка; 4 – насадка (кільця)
|  Рис. 6.3. Схема пристрою барботажного реактора з внутрішнім переливом (а) і ситоподібними тарілками (б): 1 – ковпачкова тарілка; 2 – переливна труба; 3 – ковпачок; 4 – патрубок для газу; 5 – ситоподібна тарілка (решітка); 6 – зливний поріг
Рис. 6.3. Схема пристрою барботажного реактора з внутрішнім переливом (а) і ситоподібними тарілками (б): 1 – ковпачкова тарілка; 2 – переливна труба; 3 – ковпачок; 4 – патрубок для газу; 5 – ситоподібна тарілка (решітка); 6 – зливний поріг
|
Порожниста колона з розбризкуванням рідини(рис. 6.4). У реакторах такого типу розвиток поверхні рідкої фази відбувається її диспергуванням, тобто, розбризкуванням, розпиленням пневматичним або механічним шляхом в об'ємі чи потоці газу. Такий реактор застосовується, наприклад, у виробництві сульфатної кислоти.
Пінні апарати(рис. 6.5) за інтенсивністю роботи значно перевершують барботажні при менших витратах енергії. У пінних апаратах потік газу проходить знизу вгору через решітку з такою швидкістю, при якій сили тертя газу об рідину врівноважують її масу. Внаслідок утворюється киплячий шар рухомої піни у вигляді швидко рухомих плівок, крапель, струменів рідини, тісно перемішаних з бульбашками і струменями газу. Швидкість газу у перетині апарата може складати до 4,5 м/с (в 2-4 рази більше, ніж у барботажних колонах). При більш високих швидкостях газу піна руйнується і виноситься з газом. При швидкості газу менш ніж 1 м/с рідина протікає через решітку і піна не утворюється. Для стабілізації піни використовують решітку з вертикально розташованих перехресних пластин. Стабілізатор забезпечує рівномірну висоту піни і рівномірну швидкість газу по перетину апарата.
Для абсорбційно-десорбційних процесів застосовують головним чином багатополичкові пінні реактори з переливними трубами. Число полиць визначається заданими ККД і селективністю процесу.

| |
| Рис. 6.4. Порожниста колона з розбризкуванням рідини: 1 – корпус; 2 – подвійний розпилювач рідини; 3 – одинарний розпилювач рідини | Рис. 6.5. Пінний апарат: 1 – корпус; 2 – решітка; 3 – стабілізатор піни; 4 – вхід газу; 5 – подача рідини; 6 – краплевловлювач; 7 – вихід газу; 8 – вихід пульпи |
6.3. Процеси і реактори у системі газ-тверде тіло (Г–Т)
Некаталітичні процеси у системі Г–Т широко застосовуються у хімічній промисловості. До них належать адсорбція і десорбція газів на твердих сорбентах, піроліз твердого палива, різні види випалювання твердих матеріалів. Найбільш характерні для системи Г–Т є випалювання твердих матеріалів і адсорбційні процеси. Випалювання –це високотемпературна обробка зернистих твердих матеріалів з метою отримання твердих і газоподібних продуктів, а також для придання твердим матеріалам механічної міцності (технологія силікатів). У процесі випалювання відбувається часткове плавлення твердих речовин з утворенням рідкої фази, яка взаємодіє з іншими фазами. Одне з основних перетворень при випалюванні – це термічна дисоціація твердих речовин.
Адсорбція –це процес поглинання газів поверхнею твердих сорбентів. Адсорбція газів застосовується для вловлювання цінних летких розчинників. Подальшою десорбцією проводять їх регенерацію (рекуперацію). Адсорбція застосовується для очищення повітря від токсичних газів і парів, для розділення складних газових сумішей на компоненти і т. д. Адсорбція і десорбція є важливими стадіями каталітичного перетворення речовин. Адсорбційні процеси відбуваються тільки на поверхні твердого сорбенту.
Для більшості високотемпературних процесів випалення і газифікації твердих речовин рівновага практично повністю зміщена у бік кінцевих продуктів і тому розглядаються тільки кінетичні закономірності.
Вплив механізму гетерогенного процесу на швидкість.При вивченні швидкості процесів у системі Г–Т, зокрема кінетики випалення твердих матеріалів, часто приймають за основу модель сферичної частинки з непрореагованим ядром. Згідно з цією моделлю хімічна реакція спершу відбувається на поверхні твердої частинки, а потім поступово проникає у середину частинки з утворенням шару твердих, пористих продуктів реакції ("золи"). Елементарні стадії процесу такі: дифузія газоподібного реагента з потоку газу до твердої поверхні; внутрішня дифузія газоподібного реагента через шар "золи"; хімічна реакція на поверхні твердого реагента; дифузія газоподібних продуктів реакції через шар "золи"; зовнішня дифузія газоподібних продуктів в ядро газового потоку.
На рис. 6.6 показано зміну концентрації газоподібного реагента А при реакції А(г) + В(т) ® Продукти (для моделі сферичної частинки з непрореагованим ядром). Оскільки всі елементарні стадії взаємодії Г–Т йдуть послідовно, загальна швидкість процесу визначається швидкістю найбільш повільної (лімітуючої) стадії.
Основні типи реакторів для процесів у системі Г–Т.Ці реактори показані на рис. 6.7. Деякі виробничі високотемпературні процеси проводяться в автоклавах, контактних апаратах, котлах, випарювальних апаратах і т. ін. Більшість некаталітичних процесів між твердими і газоподібними речовинами ґрунтується на хімічних реакціях і здійснюється при високих температурах. Хімічні реактори, що застосовуються для таких процесів, мають загальні характерні особливості і називаються печами.

Рис. 6.6. Зміна концентрації газоподібного реагента Сr у ході взаємодії зі сферичною твердою частинкою: 1 – газова ламінарна плівка; 2 – шар продуктів реакції; 3 – непрореаговане ядро. Лімітуючі стадії: а – зовнішня дифузія; б – внутрішня дифузія; в – хімічна реакція; rч – радіус частинки; rя – радіус ядра
Промисловою піччюназивається апарат, в якому за рахунок горіння палива і інших хімічних перетворень або застосування електричної енергії виробляється теплота, що використовується для теплової обробки різних речовин, які при цьому зазнають ряду фізичних і хімічних перетворень.
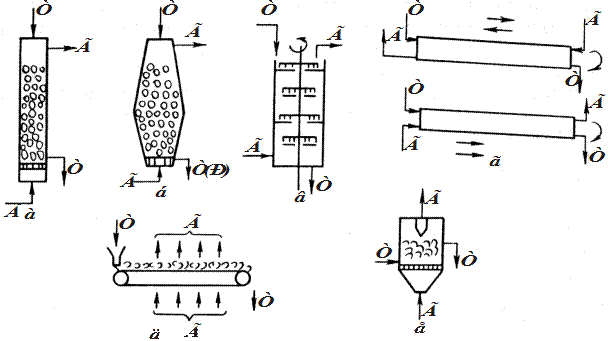
Рис. 6.7. Типи реакторів для процесів з участю газових і твердих реагентів (Г–Т) для політермічного (а-д) і ізотермічного (е) режимів: а – протитечійний (завантаження і вивантаження твердих матеріалів порціями); б – протитечійний з рухомою твердою фазою; в – поличковий з механічною мішалкою; г – барабанний з корпусом, що обертається; д-з транспортуванням твердої фази; е – з киплячим шаром
За способом нагрівання печі класифікують на:
· печі прямого нагрівання;
· печі непрямого нагрівання.
В печах прямого нагрівання джерело теплової енергії безпосередньо стикається з матеріалом, що нагрівається (цементні печі, печі киплячого шару, домни, конвертори, електродугові та шахтні печі, печі для випалювання сульфідних руд), або теплота передається до матеріалу через нагріте повітря чи топкові гази (печі для виплавляння металів, тунельні печі).
Загальне рівняння теплопередачі для паливних печей прямого нагрівання має такий вигляд:
Q = aFDt,
де: Q – кількість теплоти, що передається за одиницю часу; Dt – середня різниця температур теплоносія і матеріалу, що нагрівається; F – поверхня нагрівання матеріалу; a – коефіцієнт тепловіддачі, який залежить від природи матеріалу, конструкції печі, характеру роботи та ін.
Для інтенсифікації процесів теплопередачі у цих печах треба збільшувати рушійну силу теплопередачі, поверхню теплообміну та коефіцієнт тепловіддачі.
В печах непрямого нагрівання теплоти від джерелатеплової енергії передається матеріалу, що нагрівається, через стінку (коксові, ретортні, муфельні, тигельні, трубчасті та інші печі).
Для паливних печей непрямого нагрівання
Q = K1FDt,
де К1 – коефіцієнт теплопередачі, який у загальному випадку дорівнює:
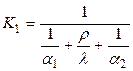 ,
,
де: a1 – коефіцієнт тепловіддачі від теплоносія до стінки, що відділяє матеріал;
a2 – коефіцієнт тепловіддачі від стінки до матеріалу; r – товщина стінки; l – теплопровідність стінки.
Шахтні печі –це печі прямого нагрівання. Твердий матеріал рухається вниз протипотоку газів, які реагують з твердим матеріалом на поверхні і у порах кусків. У шахтних печах виплавляють чавун, випалюють вапняк, сульфідні руди, газифікують тверде паливо та ін. Вони відзначаються великими розмірами і потужністю. Робота шахтних печей безперервна, повністю механізована і автоматизована. Прикладом шахтної печі може бути доменна піч, подана на рис. 6.8.
Для виробництва цементу, силікатних матеріалів, глинозему, кальцинованої соди застосовують барабанні печі прямого нагрівання. Довжина цих печей досягає 200 м, діаметр – 5 м, температура – до 1500 °С.
Для випалювання вогнетривких матеріалів, різних керамічних виробів, для напівкоксування сланців, сухої перегонки дерева, виплавляння сірки застосовують тунельні (канальні) печі.
Для коксування вугілля, випалення кераміки, у виробництві солей використовують камерні печі.
Для хімічної переробки палива і в органічному синтезі використовують трубчасті печі, в яких відбувається непрямий нагрів сировини, яка рухається по трубах з великою швидкістю.
Електричні печі застосовуються в електротермічних процесах, де потрібні високі температури – до 3500 °С. Їх використовують у металургійній і хімічній промисловості для виробництва спеціальних сталей, феросплавів, кольорових і рідкісних металів, карбідів металів, фосфору, сірковуглецю, озону, ацетилену, кварцового скла та ін.

Рис. 6.8. Схема доменної печі: 1 – засипний апарат; 2 – газовідводи; 3 – стальний кожух; 4, 5 – футеровка; 6 – холодильники; 7 – опорне кільце; 8 – кільцевий повітропровід;
9 – жолоб для чавуну; 10 – жолоб для шлаку
Електричні печі поділяються на печі опору, дугові, комбіновані та індукційні. У печах опору провідником струму є матеріал, який підлягає обробці і має великий опір (печі прямого нагрівання) або струм проходить через провідник з великим опором і виділена теплота передається матеріалу (печі непрямого нагрівання). У дугових печах електрична дуга утворюється між електродами у масі самого матеріалу, що нагрівається (пряме нагрівання) або матеріал нагрівається за рахунок теплоти випромінювання від дуги, що виникає між двома електродами. В індукційних печах нагрівають електропровідний матеріал струмом, індукованим у самому матеріалі або теплопередачею від нагрівача, в якому збуджується індукований струм.