 |
|
Основные аминокислоты.
УДК: 547
© Домбровский В.А., Аксёнов В.Н. Учебно-практическое пособие – М., МГУТУ, 2004.
Учебно – практическое пособие предназначено для более глубокого изучения раздела «Аминокислоты» в органической химии. Материал данного раздела изложен на современном научном уровне.
Пособие предназначено для студентов технологических специальностей 2 и 3 курса всех форм обучения.
Авторы: Домбровский Владимир Андреевич, Аксёнов Виктор Николаевич.
Рецензенты: Профессор, д.х.н. «Синтез полимеров» МГАТХТ ми. М.В. Ломоносова Грицкова И.А.
Доцент, к.х.н. каф. «Органической химии» МГУПБ Фонский Д.Ю.
Редактор: Свешникова Н.И.
© Московский государственный университет технологий и управления, 2004
109004, Москва, Земляной вал, 73.
СОДЕРЖАНИЕ
Введение ……………………………………………………………………..4
1.Понятие об аминокислотах…………………………………………………5
2.Методы получения аминокислот……………………………………..…..14
3.Биологическое значение аминокислот……………………………………17
4.Физические и химические свойства аминокислот…………...………….19
5. Пептиды ………………………………………………………..………… 25
6.Оптическая изомерия аминокислот……………………………………….27
7. Номенклатура оптически активных соединений в применении
к аминокислотам…………………………………………….…………….30
8. Задачи для самостоятельного решения…………………………………..33
9. Тестовые задачи для самостоятельного решения……………….……….34
10. Тестовые задачи для самостоятельного решения с ответом…….…….37
9. Литература……………………………………………………….……….39
Введение.
Известно, что форма белка определяет его функции. Предсказание, какая молекула получиться из последовательности конкретного гена - одна из важных задач, встающих после определения генома человека и геномов других животных.
Белки состоят из небольших молекул, называемых аминокислотами. Каждая конкретная аминокислота кодируется определённой последовательностью (триплетом) ДНК. Однако до сих пор не известно, почему конкретные белки выглядят именно так, а не иначе.
Белковая молекула приобретает собственную конфигурацию после "сворачивания" аминокислотной цепи в трёхмерную структуру. В настоящее время для определения пространственной структуры белков исследователи используют технологии, которые основаны на определении положения каждого атома в данном конкретном белке. В первую очередь это методы ядерного магнитного резонанса (ЯМР) и кристаллографии. Но, принимая во внимание громадное количество атомов даже в простейшей белковой молекуле, очевидно, что такие методы очень трудоемки, длительны и в ряде случаев малоэффективны.
Ученые заинтересовались поэтому, возможно ли предсказывать трёхмерную структуру белка, основываясь лишь на известной последовательности его аминокислот (или генетического кода, который определяет последовательность аминокислот). Зная свойства аминокислот притягиваться или отталкиваться друг от друга и применив компьютерное моделирование, теоретически можно спрогнозировать и их расположение в пространстве. Но это пока только теория. Так как многие белки содержат тысячи аминокислот, подобная задача остаётся до сих пор сложно разрешимой.
Оценивая пищевую ценность аминокислот, мы часто одни из них называем "незаменимыми", а другие - "заменимыми". Хотя с точки зрения питания все это верно, не следует упускать из виду общую биологическую значимость и незаменимость всех 20 аминокислот. Более того, можно даже заключить, что как раз "заменимые" аминокислоты более важны для клетки, чем "незаменимые", поскольку утрата способности организма (например, организма человека) синтезировать определенные аминокислоты представляется в эволюционном отношении более естественной в отношении менее важных аминокислот. Пищевые потребности в тех или иных соединениях свидетельствуют о том, что зависимость от внешнего источника метаболитов может оказаться более благоприятной для выживания организма, чем способность организма синтезировать эти соединения. Если специфический интермедиат присутствует в пище, то организм, сохраняющий способность синтезировать это соединение, передает будущим поколениям соответствующую генетическую информацию отрицательной ценности. Это свойство для организма не просто бесполезно, но даже вредно, поскольку приходится дополнительно затрачивать питательные вещества и АТР на синтез "лишних" фрагментов ДНК . В клетках прокариот число ферментов, необходимых для синтеза незаменимых аминокислот, существенно больше числа ферментов, необходимых для синтеза заменимых аминокислот. Следовательно, сохранение возможности синтезировать "легкие" аминокислоты и утрата способности к синтезу "трудных" имеют определенные биологические преимущества.
Некоторые злаки относительно бедны триптофаном и лизином, и в тех районах, где основным источником пищевого белка служат именно эти растения, а другие источники белка (молоко, рыба или мясо) в пище отсутствуют, у населения часто наблюдаются случаи тяжелой недостаточности аминокислот. В ряде районов Западной Африки широко распространены детская дистрофия ( квашиоркор ) и кахексия . Квашиоркор развивается в тех случаях, когда ребенок после отнятия от груди переводится на обедненную белком крахмальную диету. Кахексия является следствием малокалорийной диеты, обедненной специфическими аминокислотами.
Аминокислоты – это бесцветные кристаллические твердые вещества. Обычно они растворимы в воде и не растворимы в органических растворителях. В нейтральных водных растворах аминокислоты существуют в виде биполярных ионов (цвиттерионов) и ведут себя как амфотерные соединения, т.е. проявляются свойства и кислот, и оснований.
Каждая аминокислота характеризуется определенным значением рН, при котором она существует в нейтральной цвиттерионной форме в виде четко выраженного диполя (рис.4). Если при этом значении рН поместить аминокислоту в электрическое поле, то она не будет перемещаться ни к катоду, ни к аноду.
Амфотерная природа аминокислот существенна в биологическом отношении, т.к. она означает, что аминокислоты способны в растворах действовать как буферы – препятствовать изменениям рН.
I. Понятие об аминокислотах.
Номенклатура и изомерия
Аминокислоты - замещенные карбоновые кислоты, содержащие в радикале одну или несколько аминогрупп. В состав аминокислот, кроме карбоксильной и аминогрупп, могут входить другие группы, например - OH, -SH, = NН, арильные, азотсодержащие гетероциклы. Особенно важное значение имеют аминокислоты, которые представлены в таблице I.
Названия аминокислот общей формулы Н2N - (СН2n)n -СООН (n =1, 2, 3..) по систематической номенклатуре образуются от названия соответствующего углеводорода, к которому добавляются приставка амино- , окончание – овая и слово кислота. Нумерацию углеродной цепочки начинают с углерода карбоксильной группы, например:
2 - аминопропановая кислота
β α
3 2 1
H3C — CH — COOH (α -аминопропионовая кислота, α - аланин)
NН2
Для аминокислот характерна изомерия, причиной которой является изомерия углеродной цепочки или различное расположение аминогрупп в углеродной цепочке. Например, изомерами являются:
Аминокислоты
γ β α CH3
4 3 2 1 3 2 1
H3C — CH2 — СН — COOH βСH — Cα — COOH
NH2 NH2
2- Аминобутановая кислота 2- Амино 2-метилпропановая кислота
( α - аминомасляная кислота) (α -аминоизомасляная кислота)
В химии аминокислот широко используются тривиальные названия. В зависимости от нахождения аминогрупп по отношению к карбоксильной группе аминокислоты подразделяются на γ -, β -, α – и т.д. аминокислоты. В практику органической химии, биохимии и химии белка вошли также исторические названия аминокислот, которые связаны или с их свойствами, или способом получения. Такие названия происходят обычно от греческих слов. Так, сладковатую на вкус аминоуксусную кислоту называют глицин или гликокол (глюко - сладкий); цистеин был выделен из камня желчного пузыря (цисти - пузырь); лейцин - из белка казеина (лейкос - белый);
аспарагиновая кислота - из спаржи (аспарагус - спаржа); орнитин - из птичьего помета (орнитус - птица).
Все природные аминокислоты, кроме аминоуксусной кислоты, содержат асимметрические атомы углерода и поэтому они существуют в виде оптически активных D - и L - изомеров и рацематов,
например:
СООН СООН
H NH2 H2N H
CH3 CH3
α – D (-)-Аланин α- L (+)-Аланин
Оптическую активность обычно выражают в виде удельного вращения, которое определяется уравнением
[ α]λt = α/ ℓc
где α- угол вращения плоскости поляризации изучаемым веществом; С - объемная концентрация в г/см3 (количество граммов оптически активного вещества в 100 мл раствора); ℓ - длина (в дециметрах) пути, пройденного светом в веществе; t - температура раствора; λ - длина волны света, которая была использована при измерении.
Таблица1
Наиболее важные представители аминокислот.
Самая простая аминокислота


Глицин (Gly, G) аминоэтановая , аминоуксусная, гликоколь. Тпл. оС=292.
Обеспечивает минимальные стерические препятствия для соседних аминокислотных остатков.
Алкильные боковые цепи


Аланин (Ala, A) 2-аминопропановая к-та, a-аминопропановая к-та. [a]D = +2,7,
Тпл. оС=297


Валин (Val, V) Незаменимая аминокислота. 2-амино-3-метилбутановая к-та,
[a]D = -28,8, Тпл. оС= 315


Лейцин (Leu, L) Незаменимая аминокислота. 2-амино-4-метилпентановая [a]D = -10,35
Тпл. оС= 337


Изолейцин (Ile, I) Незаменимая аминокислота. 2-амин-3-метилпентановая к-та. В излейцине имеется помимо С атома еще один хиральный центр. [a]D = +14,8 Тпл.оС= 284
Боковые радикалы с карбоксильными группами
(«аминодикислоты»)

Аспарагиновая кислота (Asp, D) Аминоянтарная к-та. Карбоксильная группа боковой цепи при физиологических значениях pH диссоциирована (pKa ~ 4.3-4.7) Депротонированная форма называется аспартат. [a]D = +4,36 Тпл. оС= 251

Глутаминовая кислота (Glu, E) a -аминоглутаровая. Депротонированная форма называется глутамат. Амиды аспарагиновой и глутаминовой кислот. [a]D = +31,7 Тпл.оС= 248


Аспарагин (Asn, N) Аминоянтарная.Амидная группа полярна, но кислотными свойствами не обладает. Может участвовать в образовании водородных связей. Общее обозначение для аспарагиновой кислоты или ее амида Asx, а в однобуквенном коде B. [a]D = +4,36 Тпл. оС= 251

Глутамин (Gln, Q) Общее обозначение для аспарагиновой кислоты или ее амида Glx, а в однобуквенном коде Z.
Основные аминокислоты.


Лизин (Lys, K) 2,6- диаминогексановая к-та. Незаменимая аминокислота. Аминогруппа
+
при С атоме в нейтральных растворах протонирована (-NH3) pKa~ 10.5 [a]D = +25,9 Тпл. оС= 224



Аргинин (Arg, R) pKa гуанидиновой группы ~ 12.5 и в большинстве растворов она протонирована и стабилизирована резонансом. В ряде случаев она выступает как центр связывания фосфатных групп.


Гистидин (His, H) 2-амино-3-(3¢-имидазолил) пропановая,
Имидазольная группа боковой цепи входит в состав активных центров ряда ферментов. Атом азота в третьем положении имидазольного кольца (N-) служит акцептором и/или донором протонов pKa ~ 6.4-7.0, попеременно выступая в качестве основного или кислотного катализатора. [a]D = -39,74
Аминокислоты с гидроксильной группой


Серин (Ser, S) Гидроксильная группа способна образовывать эфиры фосфорной и органических кислот, служит местом присоединения углеводов в гликопротеидах. Серин присутствует в активных центрах ряда ферментов.


Треонин (Thr, T) 2-амино-3-оксибутановая к-та. Незаменимая аминокислота. Имеется второй хиральный центр. [a]D = -30 Тпл. оС= 251
Сер(о/у)содержащие аминокислоты
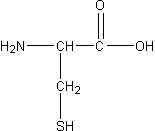

Цистеин (Cys, С) 2- амино-3-тиопропановая к-та.Способен самопроизвольно окисляться в присутствии O2 образуя «двойную» аминокислоту цистин (дисульфидные связи в белках). [a]D = -16,5 Тпл. оС= 178.


Метионин (Met, M) 2-амино-4-метилтиобутановая к-та. Незаменимая аминокислота. [a]D = +27,2
Ароматические аминокислоты


Фенилаланин (Phe, F) 2-амино-3-фенилпропановая к-та.Незаменимая аминокислота.
[a]D = -34,5 Тпл. оС= 278

Тирозин (Tyr, Y) 2-амино-3-(n-оксифенил) пропановая к-та. Донор протона в водородных связях. pKa ~ 9.5-10.9 [a]D = -10
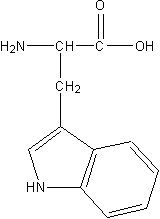

Триптофан (Trp, W) 2-амино-3-индолилпропанокая к-та. Незаменимая аминокислота.
Тирозин и триптофан поглощают в УФ области спектра (250-300 нм). [a]D = -31,5
Тпл. оС= 382
Иминокислота


Пролин (Pro, P) a-пирролидинкарбоновая к-та. Боковая цепь замыкается на аминогруппу. Пирролидиновое кольцо вызывает изгибы полипептидной цепи.
Таблица обозначений и некоторых важных свойств 20 природных аминокислот
| Amino acid | Abbreviations | mol.wt. Da | pK | Aq. solubility (g/100ml) | UV abs. Log pH~7 | |||
| 3-letter | 1-letter | -COOH | -NH3+ | R group | ||||
| alanine | ala | A | 89,10 | 2,35 | 9,87 | - | 16,6 (25°C) | - |
| arginine | arg | R | 174,20 | 1,82 | 8,99 | 12,50 | 15(21°C) | - |
| asparagine | asn | N | 132,10 | 2,14 | 8,72 | - | 2,6(25°C) | - |
| aspartic acid | asp | D | 133,10 | 1,99 | 9,90 | 3,90 | 0,5(25°C) | - |
| cysteine | cys | C | 121,20 | 1,92 | 10,70 | 8,37 | soluble | 2,48(250nm) |
| glutamic acid | glu | E | 147,10 | 2,10 | 9,47 | 4,07 | 0,86(25°C) | - |
| glutamine | gln | Q | 146,10 | 2,17 | 9,13 | - | 4,2(25°C) | - |
| glycine | gly | G | 75,10 | 2,35 | 9,78 | - | 25(25°C) | - |
| histidine | his | H | 155,20 | 1,80 | 9,33 | 6,04 | 4,2(25°C) | 3,77(211nm) |
| isoleucine | ile | I | 131,20 | 2,32 | 9,76 | - | 4,1(25°C) | - |
| leucine | leu | L | 131,20 | 2,33 | 9,74 | - | 2,4(25°C) | - |
| lysine | lys | K | 146,20 | 2,16 | 9,06 | 10,54 | soluble | - |
| metionine | met | M | 149,20 | 2,13 | 9,28 | - | soluble | - |
| phenylalanine | phe | F | 165,20 | 2,20 | 9,31 | - | 3,0(25°C) | 3,97(206nm) 2,30(257nm) |
| prolyne | pro | P | 115,10 | 1,95 | 10,64 | - | soluble | - |
| serine | ser | S | 105,10 | 2,19 | 9,21 | - | 25(20°C) | - |
| threonine | thr | T | 119,10 | 2,09 | 9,10 | - | soluble | - |
| tryptophan | trp | W | 204,20 | 2,46 | 9,41 | - | 1,14(25°C) | 4,67(219nm) 3,75(280nm) |
| tyrosine | tyr | Y | 181,20 | 2,20 | 9,21 | 10,46 | 0,045(25°C) | 3,9(222nm) 3,15(274nm) |
| valine | val | V | 117,10 | 2,29 | 9,74 | - | 8,8(25°C) | - |
Все входящие в состав белков аминокислоты представляют собой L - формы;
D - формы встречаются в природе редко (их получает синтетически). Во всех тканях присутствуют только L- изомеры. После гибели организма они начинают медленно переходить в D - изомеры. Установив соотношение L - и D - аминокислот, можно определить возраст находки.
2. Методы получения аминокислот
Основным способом получения многих аминокислот является гидролитическое расщепление белковых веществ. Белки гидролизуют при нагревании и под давлением (в автоклавах) с растворами щелочей или кислот, а также с помощью ферментов. При этом макромолекулы белков, которые состоят из остатков α - аминокислот, связанных между собой амидными (пептидными) связями -NН-С=0, расщепляются на отдельные α -аминокислоты. Таким образом, при гидролизе участка молекулы белка Б в результате разрыва пептидных связей получают смесь α - аминокислот.
Б
….–NH - CH – C – NH – CH– C -NH–CH – … ® R1–CH–COOH + R2 -CH - COOH +
ï ║ ï ║ ï ï ï
R1 O R2 O R3 NH2 NH2
HO– H HO– H HO–H
+ R3 – CH – COOH + …
ï
NH2
Полученные из белковых гидролизатов аминокислоты разделяют методами ионообменной хроматографии, электрофореза и газожидкостной хроматографии. Или же полученные аминокислоты переводят в эфиры, которые дальше разделяют фракционной разгонкой в вакууме. После омыления (гидролиза) сложных эфиров получают аминокислоты. Разработан микробиологический метод получения некоторых аминокислот. Определенного вида организмы в процессе их жизнедеятельности питаются газообразными углеводородами и углеводородами нефти. При этом в клетках, и за их пределами накопляются определенного вида аминокислоты. Таким путем получают лизин, глутаминовую кислоту и др.
Известно большое число синтетических методов получения аминокислот, из которых наиболее важными являются:
1.Замещение галогенов на аминогруппу в галогензамещенных карбоновых кислотах действием аммиака на их аммонийные соли
H+
R-СН-СООNH4 + 2NH3 R-CH-COONH4 R-CH - COOH
-NH4Br NH3
Br NH2 NH2
2. Получение из циангидринов (оксинитрилов), которое заключается в действии на альдегиды или кетоны цианистоводородной кислоты и аммиака по А.Штреккеру (немецкий химик). Образующиеся нитрилы аминокислот далее гидролизуют в
(α-аминокислоты, например:
NH3 H2O
CH3 – CH = O+HCN CH3 –CH –CN CH3 – CH – CN CH3 – CH –COOH
-H2O - NH3
OH NH2 NH2
3. Н.Д.Зелинский (советский химик-органик) улучшил этот метод, заменив HCN смесью цианида калия и хлористого аммония. В этом случае образуется цианид аммония, который реагирует с карбонильным соединением, в результате образуется α -аминокислота.
HCN + NH4CI KCI + NH4CN
H2O
R2 – C = O + NH4CN + R2 – CH – CN R2 – CH – COOH
-NH3
NH2 NH2
4. β -Аминокислоты могут быть получены взаимодействием аммиака с непредельными карбоновыми кислотами..В этом случае присоединение аммиака к этиленовой связи проходит против правила Марковникова. Например:
СH2 = CH - CООН + NH3 СН2 –СН2 –СООН
Акриловая кислота
NH2
β - аланин
5. β-Аминокислоты также получают по методу В.М.Родионова (советский химик - органик) взаимодействием карбонильных соединений с диэтилмалоновым эфиром и аммиаком:
R – CH = O + CH2(COOC2H5)2 +NH3 R – CH – CH2 – COOH + C2H5OH + CO2
NH2
Для синтеза отдельных аминокислот используются специальные методы. Для получения ε - аминокапроновой кислоты исходными веществами являются фенол или циклигексан, которые гидрированием и соответственно окислением превращают в циклогексанол. Последний после ряда химических реакций превращают в капролактам, и наконец, в ε -аминокапроновую кислоту.

циклогексанол циклогесанон оксим циклогексанона

капролактам ε -аминокапроновая кислота
На основе капролактама Е.И.Клабуновский с сотрудниками разработали «комбинированный метод» синтеза лизина. Для этого капролактам нитруют и полученный нитрокапролактам рядом превращений переводят вL –лизин
нитрование 1.гидрирование

 2.гидролиза
2.гидролиза
капролактам нитрокапролактам
H2N -(CH2)4 -CH- COOH
ï
NH2
L-лизин
Лизин – одна из незаменимых аминокислот. Особенно эффективны добавки лизина к корму сельскохозяйственных животных. Тонна этой аминокислоты позволяет уменьшить расход кормового зерна на 125 тонн. Мировое производство лизина составляет 70 тонн в год.
А.Н.Несмеянов (советский химик - органик) с сотрудниками разработал синтез
b-аминокислот из продуктов теломеризации зтилена и четыреххлористого углерода в присутствии инициаторов радикальной полимеризации (R'). Полученный теломер последовательно гидролизуют в b -хлоркарбоновую кислоту, которую потом действием аммиака превращают в b-аминокислоту.
R· H2O NH3
CH2 = CH2 + CCℓ4 ® Cℓ - (CH2 -CH2)n CCℓ3 ® Cℓ (CH2-CH2)n - COOH ®
H+
H2N - (CH2 -CH2)n - COOH
n=1 b-аминопропионовая кислота
Этим путем получают кислоты: g -аминоэнантовую (п=3);
ε- аминопеларгоновую кислоту (п=4); ω- аминоундекановую (п=5) и др., которые являются исходными соединениями в синтезе полиамидных волокон (энант, пеларгон и др.), а также для получения душистых веществ.
3. Биологическое значение аминокислот
Аминокислоты имеют исключительно важное биологическое значение. Они являются простейшими звеньями», своеобразными "кирпичиками" в структуре высокомолекулярных природных веществ - белков, которые в свою очередь являются основой живой природы, а значит, мыслящей материи. Аминокислоты принимают участие в жизненно важных физиологических функциях животных и растений. Большинство аминокислот синтезируется в живых организмах. Такие аминокислоты называются заменимыми. Вместе с тем существует восемь витагенных (незаменимых) аминокислот (табл. 2). Незаменимые аминокислоты организмом не синтезируются, они обычно поступают в организм с белковой пищей (молоко, мясо и др.)» из которой они путем превращений и образуются. Содержание незаменимых аминокислот в пище необходимо для нормального роста и функционирования организма.
При нехватке одной из аминокислот в белке он становится недостаточно полноценным и не полностью усваивается организмом. Поэтому аминокислоты, полученные синтетическим или микробиологическим путем, должны доставляться в пищу для повышения ее полноценности. С этой целью широко используется лизин, которого не достает в растительной пище (белке пшеницы). Смеси аминокислот применяются в медицине для питания больных (парантеральное питание). Отдельные аминокислоты используют в разнообразных синтезах, в аналитической химии, некоторые аминокислоты применяются з пищевой промышленности в качестве вкусовых добавок, например, мононатриевая соль глутаминовой кислоты, придающая вкус и запах куриного бульона.
Из аминокислот, не входящих в состав белков, следует отметить о- аминобензойную (антрониловую) кислоту, которая применяется в синтезе красителей и лекарственных препаратов, пищевой промышленности

антраниловая кислота
Витагенные (незаменимые) аминокислоты
Таблица 2
 лизин ,
лизин ,  изолейцин,
изолейцин,
 Валин,
Валин,  треонин,
треонин,
 метионин,
метионин,  фенилаланин,
фенилаланин,
 триптофан,
триптофан,  лейцин.
лейцин.
Некоторые аминокислоты используются в медицине в качестве лекарственных препаратов при заболеваниях нервной системы, желудочно-кишечного тракта, печени и др. Так, глутаминовая кислота применяется при лечении шизофрении, эпилепсии и некоторых других заболеваний. Глутаминат натрия, производство которого достигает 200 тыс. тонн в год - незаменимая добавка в пищу, очень хороший консервант, зарекомендовал себя как эффективная добавка в корм животных.
4. Физические и химические свойства аминокислот.
Аминокислоты - бесцветные кристаллические вещества с относительно высокими температурами плавления. В ряде случаев аминокислоты плавятся с разложением, поэтому температура плавления не является характерной константой для них. Аминокислоты хорошо растворяются в воде и плохо в неполярных растворителях, α-L-аминокислоты, полученное из белков, горьковаты на вкус, тогда как D - изомеры сладкие на вкус. Аминокислоты - бифункциональные соединения, в молекулах которых находятся одновременно две противоположные по кислотности группы: карбоксильная -СООН, амино группа –NH2. Карбоксильная группа является носителем кислотных свойств, а аминогруппа - носителем основных свойств. Следствием такой бифункциональности является амфотерность аминокислот. В свободном состоянии в растворах между карбоксилами и аминогруппами аминокислот осуществляется химическое взаимодействие, своеоборазная реакция нейтрализации, результатом которой является образование внутренней соли (биполярного иона). Так, кристаллический глицин (т.пл. 2360С с разложением) можно описать обычной формулой, в то время как на самом деле он представляет собой биполярный ион II, который иногда изображают в виде "бетаина" (формула III):
.. +
H2N-CH2-C- O-H ® H3N-CH2-COO-
I ║ II
O
CH2 – C = O
H3N O III
1. Биполярная структура аминокислот согласуется с тем, что они нелетучие кристаллические вещества, способные растворяться в полярных растворителях (вода), не растворяются в неполярных растворителях (диэтиловый эфир, бензол и д.р.). В ИК-спектрах аминокислот отсутствуют частоты, характерные для карбоксильной группы (nCOOH = 1650см-1) и частоты для аминогрупп (nHN2 =3320см-1). Водные растворы аминокарбоновых кислот показывают нейтральную реакцию, не изменяют цвет обычных индикаторов. Биполярная структура также хорошо согласуется с поведением водных растворов аминокислот в электрическом поле. Если в водный раствор аминокислоты пропускают электрический, ток, то в зависимости от рН среды она может мигрировать к аноду или катоду. Те значения рН, при которых аминокислот, оставаясь электронейтральной, не мигрирует под влиянием электрического тока ни к аноду, ни к катоду,
называют изоэлектрической точкой:
+
OН- (pН выше, чем в изо- NH3-CH2-COO- Н+ (pН ниже, чем изоэлектрической
электрической точке) изоэлектрическая точке)
точка:
аминокислота не
мигрирует ни к катоду,
ни к аноду
NH2 –CH2 –COO- +
NH3-CH2-COOH
наличие аминогруппы; наличие недиссоциированной
аминокислота ведет себя карбосильной группы;
как анион - мигрирует аминокислота ведет себя,
к аноду как катион – мигрирует к катоду '
2. Вследствие наличия в молекулах аминокислот функциональных групп кислотного и основного характера α- аминокислоты являются амфотерными соединениями, т.е. они образуют соли как с кислотами, так и со щелочами.
+
H2N– CH–COOH + HCl ® [H3N– CH–COOH] Cl-(хлористоводородная соль глицина
I I a- аминокислоты)
R R
| H2N– | CH–COOH + NaOH ® H2N– I R | CH–COO-Na+ (натриевая соль α-аминокислоты) + H2O I R |
3. Важной реакцией, в которой участвуют карбоксильные группы, является образование сложных эфиров, полученных взаимодействием аминокислот со спиртами (обычно в присутствии кислых катализаторов). В реакции со спиртами образуются сложные эфиры.

этиловый эфир аланина
4) a- Аминокислоты можно ацилировать, в частности, ацетилировать, действуя уксусным ангидридом или хлористым ацетилом. В результате образуются N- ацильные производные - аминокислот (символ "N" означает, что ацил связан с атомом азота).

N – ацетилаланин

5) a- Аминокислоты вступают друг с другом в реакцию поликонденсации, приводя к амидам кислот. Продукты такой конденсации называются пептидами. При взаимодействии двух аминокислот образуется дипептид:
| H2N– | H I CH– | O II C–OH + H–NH– | CH3 I CH– | O II C–OH ® |
| глицин | аланин |
| ® H2N– | H I CH– | O II C–NH– | CH3 I CH– | O II C–OH + H2O |
глицилаланин
При конденсации трех аминокислот образуется трипептид и т.д.
Аминокислоты взаимодействуют с малорастворимыми в воде гадроксидами тяжелых металлов, растворяя их. При этом образуются, как правило, окрашенные комплексные соединения. Так, с гидроксидом меди (II) аминокислоты образуют комплексы, окрашенные в темно-синий или сине-фиолетовый цвет.
+
2 H2N– CH2–COOH + Cu(OH)2 ® O = C -O - CuNH2 – CH2
ï .. ï
H2C - NH2 O- C =O
В полученном комплексе атом меди соединен ионными связями с атомами кислорода карбоксильных групп и донорно- акцепторными связями с атомами азота аминогрупп за счет свободных пар р-электронов и вакантных d- орбиталей атома меди. В этом случае образуются циклические структуры (хелатные соединения), для которых характерно окрашивание. Являясь би функциональными соединениями,. аминокислоты взаимодействуют как по аминогруппе, так и по карбоксильной.
При осторожном нагревании аминокислот возможно декарбоксилирование, в результате которого образуются первичные амины
t
H2N– CH–COOH ® R– CH2– NH2 + CO2
ï
R
В живых организмах a - аминокислоты претерпевают разнообразные превращения, в том числе и декарбоксилирование. При этом образуются амины, которые обладают высокой биологической активностью (биогенные амины). Например, при декарбоксилировании глутаминовой кислоты образуется g- аминомасляная кислота, которая находится в мозговых тканях и выполняй в организме функции нейрогормонального ингибитора.
фермент g b a
HOOC - CH - CH2 -CH2 -COOH CH2 - CH2 -CH2 -COOH + CO2
ï ï
NH2 NH2
глутаминовая кислота g- аминомасляная кислота
Реакция декарбоксилирования аминокислот проходит при разложении белковых тел, которые переходят в аминокислоты, а затем в амины (трупные яды).
В основе качественного и количественного определения аминокислот лежит нингидринная реакция. Нингидрин (гидрат трикетогидриндена) при взаимодействии с аминокислотами в щелочной среде образует соединения, окрашенные в сине-фиолетовый цвет. Например, с a - аланином нингидринная реакция описывается следующей последовательностью превращений:
СН3 −СН−СООН + 2H2O•  ®
®  + СН3 − СНО + СО2 +NН3
+ СН3 − СНО + СО2 +NН3
ô нингидрин
NН2
H − N−H + 2H2O •  +
+  -4H2O
-4H2O
ô
H

кетонная форма


енольная форма окрашенное соединение
Реакция аминокислот, в которых участвует аминогруппа, подобны реакциям первичных аминов.
При взаимодействии с азотистой кислотой в кислой среде аминогруппа в аминокислотах замещается на оксигруппу. При.этом выделяется азот и образуется оксикарбоновая кислота.
 + HNO2 ® CH3 - CH- COOH + N2+ H2O
+ HNO2 ® CH3 - CH- COOH + N2+ H2O
ï
OH
a- аланин молочная кислота
Реакция используется для количественного определения аминокислот по объему выделяющегося свободного азота (метод Ван-Слайка).
С алкилирующими реагентами (галогеналкилы, диалкилсульфаты и др.) аминогруппа аминокислот, подобно аминам, алкилируется;
H2N- CH2 -COOH + (CH3)2 SO4 ® (CH3)2N - CH2- COOH + H2SO4
диметилсульфатN,N– диметилгликокол
С ангидридами карбоновых кислот аминокислоты вступают в реакцию ацилирования с образованием N -ацилпроизводных. Аналогично ацилирование проходит при взаимодействии аминокислот с хлорангидридами. Например, гликокол с хлористым бенэоилом образует о кристаллический бензоилгликокол (т.пл.187,5), известный под названием гиппуровой кислоты:
H2N- CH2 -COOH + C6H5 -C -Cℓ ® C6H5 -C -NH -CH2 -COOH
║ -HСℓ ║
O O
гилпуровая кислота
Гиппуровая кислота вырабатывается в организмах травоядных животных, затем в значительных количествах выделяется с мочой.
Своеобразные и характерные реакции аминокислот проходят при нагревании и в присутствии водоотнимающих веществ. Пои этом по-разному осуществляется превращение аминокислот в зависимости от расположения амино- и карбоксильной групп в их молекулах. a - Аминокислоты при нагревании вступают в реакцию самоацилирования прикоторой из двух молекул a - аминокислоты за счет водородов аминогрупп и гидроксилов карбоксильных групп выделяются две молекулы воды, а из остатков аминокислот образуются дикетопиперазины. Последние представляют собой кристаллические нейтральные вещества, которые при гидролизе превращаются в дипептиды, а при восстановлении - в азотистые гетероциклы ряда пиперазина.
 -2H2O
-2H2O 
+4Н2
+H2O  Пиперазин
Пиперазин
H2N−CH2−C−NH−CH2−COOH
║
O дипептид
a -Аминокислоты при нагревании, особенно в присутствии кислотных реагентов, за счет аминогруппи a-водородных атомовалкильной части молекулы легко отщепляют аммиак, образуя a, b ненасыщенные кислоты:
CH2 -CH -COOH ® CH2 = CH -COOH + NH3
ï ï акриловая кислота
NH2 H
b - аланин
g, d,e - аминокислоты также при нагревании легко вступают во внутримолекулярную реакцию самоацилированкя. При этом элиминируется вода за счет атома водорода, аминогруппы и гидроксида пространственно сближенной с ней карбоксильной группы. В результате образуется циклическая структура - лактам;
g β α
CH2− CH2− CH2 -H2O CH2 − CH2 CH2 −CH2
NH2 C = O CH2 CH2
N C N C
OH +Н2О ô ║ ô
H O OH
g-аминомасляная кислота лактамная форма лактимная форма
лактам g - аминомасляной кислоты (бутиролактам)
Лактамы, как и амиды, в кислотной и щелочной средах гидролизуются, превращаясь в соответствующие аминокислоты. Для лактамов характерна лактам- лактимная таутомерия. Под влиянием соседней карбонильной группы >С=0 атом водорода иминной группы >N -H обладает значительной подвижностью и сравнительно легко смещается к кислороду карбонильной группы, образуя енольную форму гидроксила, а вся молекула превращается в лактимную форму. Между лактимной и лактамной формой устанавливается таyтoмepнoe равновесие. Лактамы и лактимы могут давать как N-, так и 0-производные. Промышленно важным является лактам e - аминокапроновой кислоты - капролактам (исходное вещество для получения полимера капрона):
e d g b a
CH2− CH2− CH2 −CH2− CH2− C =O ® CH2− CH2− CH2 −CH2− CH2− C =O
ô ô -H2O
NH − H OH NH
ε- аминокапроновая кислота ε-капролактам
5. Пептиды
Пептиды - это амиды линейной структуры, которые можно рассматривать как результат взаимодействия аминогрупп и карбоксилов разных по строению (или одинаковых) аминокислот.
Пептиды могут быть получены гидролизом природных белков. Синтетические методы получения пептидов разработал Э.Фишер (немецкий химик - органик) в 1907 г. Так, по одному из способов конденсируют хлорангидрид a - галогенкарбоновой кислоты с a - аминокислотой с последующей обработкой продукта конденсации аммиаком, получая в результате дипептид, например:
CH3 - CH -C =O + H- NH -CH2 - COOH ® CH3 -CH -C- NH -CH2 -COOH ®
ï ï -HCl ï ║
Br Cl Br O
хлорангидрид
a -бромпропионовой
кислоты
+ 2NH3 CH3 - CH- C- NH - CH2 - COOH
- NH4Br ï ║
NH2 O
дипептид аланил – глицил
Продолжая наращивать таким путем пептиднуго цепь, можно получить пептиды со значительным числом остатков аминокислот, так называемые полипептиды.
В зависимости от числа аминокислотных остатков различают ди-, три-... полипептиды. Принято относить к полипептидам соединения с молекулярной массой до 10.000. Полипептиды с большей молекулярной массой называют белками. Названия пептидов образуются по аминокислотам, которые входят в пептид, за исключением последней в цепи, которая содержит свободную карбоксильнуюг группу, меняя в окончании буквы "Н" на букву "Л", например трипептид, который состоит из остатков глицина, аланина и цистеина, называют глицил-аланил-цистеин.
H2N - CH2 - COOH + H2N- CH - COOH + CH2 - CH - COOH
ï ï ║ -2H2O
CH3 SH NH - H
глицин a -аланин цистеин
H2N - CH2- C - NH - CH - C - NH - CH - COOH
║ ï ║ ï
O CH3 O H2C - SH
трипептид глицин – аланил - цистеин
ï
В пептидах амидная группа 0=C-NH - называется пептидной группой или пептидной связью), которая соединяет остатки аминокислот. Именно по пептидной группе осуществляется реакция расщепления полипептидных цепей, например при гидролизе полипептидов.
Полипептиды - это бесцветные кристаллические вещества, растворимые, в воде. Полипептиды составляют основу биополимеров - белков.
Все атомы пептидной связи находятся в одной плоскости. Это связаяо с сопряжением между электронамиp -связи C=O - группы и не поделенной пары электронов атома азота
O:
ï: ××
- C = N -
ï
H
Благодаря сопряжении связь C-N имеет частичный характер двойной связи, вращение вокруг которой заторможено. Атомы кислорода и водорода находятся преимущественно в транс-положении.
Поскольку на долю пептидных связей приходится 1/3 всех связей полипептидного остова, то это приводит к ограничению пространственного расположения пептида. Только радикалы аминокислотных остатков могут свободно вращаться в цепи.
Кроме сильных ковалентных пептидных связей в молекулах белков возникают взаимодействия (водородные, ионные, гидрофобные, дисульфидные) между функциональными группами, которые поддерживают специфическую пространственную форму молекулы и обеспечивают реализацию ее биологических функций.
Полипептиды встречаются в организмах животных и человека, являясь чаще всего продуктами распада белков.
Ряд, пептидов играет важную биологическую роль. К ним можно отнести, например, декапептид, известный как грамицидин С- антибиотическое вещество, гормоны гипофиза окситоцин, вазопрессин и адренокортикотропный гормон. Важнейшим пелтидом является инсулин - гормон поджелудочной железы, снижающий содержание сахара в крови. Недостаток инсулина вызывает сахарный диабет.