 |
|
Біологічні функції білків і пептидів, їх хімічна будова
РОЗДІЛ 6. ОБМІН АМІНОКИСЛОТ
Основою структури всіх живих організмів є білки. Білки — високомолекулярні органічні речовини, молекули яких побудовані із залишків амінокислот. Назва протеїни (від грец. protos — перший, найважливіший), очевидно, найбільш точно відображає першочергове біологічне значення цього класу речовин. Вони зустрічаються в усіх живих організмах і є основою їх життєдіяльності. Добова потреба в білках для дорослої людини і дітей неоднакова, що пов'язано з фізіологічними особливостями функціонування їх організмів. Для дорослої людини поступлення в організм за добу 1,5–2 г білків на 1кг маси вважається нормою, тоді як для дітей потрібно 5–6 г.
Біологічні функції білків і пептидів, їх хімічна будова
В організмі білки виконують різні функції, серед яких найважливішими є :
Структурна — 18 – 21 % загальної сирої маси, та 45 – 50 % сухої маси організму людини і тварин становлять білки; вони беруть участь в утворенні структурної основи клітин та їх органел, формуванні покривних, сполучних тканин тощо;
Каталітична — понад 2000 білків ферментативноактивні. Всі ферменти є білками. В порівнянні з іншими каталізаторами вони характеризуються високою ефективністю і найбільш тонкою вибірковістю cубстратною специфічністю;
Рецепторна — за участю білків здійснюється передача та прийняття сигналів поверхнею клітин, забезпечується міжклітинна взаємодія;
Транспортна — за допомогою білків забезпечується активний транспорт речовин та іонів крізь клітинні мембрани та між органами й тканинами організму; транспорт фармакологічних препаратів;
Захисна — білкову природу мають антитіла та імуноглобуліни, що забезпечують імунні реакції організму; процеси зсідання крові (фібриноген, тромбін тощо). Завдяки багаточисленних функціональних груп білки можуть зв’язувати токсичні сполуки (важкі метали, алкалоїди, токсини) і знешкоджувати їх;
Механохімічна або скоротлива — за допомогою білків забезпечується рух, скорочення, розслаблення м'язів, робота внутрішніх органів: в цьому числі екскурсія легень, робота серця, рух сперматозоїдів та інші;
Субстратно-енергетична — за допомогою білків організм одержує 10 – 15 % енергії, цю функцію виконують резервні білки;
Регуляторна — обмін речовин в організмі регулюється різними гормонами білкової природи. Деякі білки відіграють роль інгібіторів активності ферментів і таким шляхом регулюють їх дію. Відома група білків-регуляторів генома.
Когенетична функція виконується складними білками — нуклеопротеїдами. Білки не є генетичним матеріалом, але допомагають нуклеїновим кислотам реалізувати здатність до відтворення і перенесення інформації.
До важливих функцій білків відносять також їх здатність підтримувати онкотичний тиск в клітинах і крові; буферні властивості, що підтримують гомеостатичне значення рН внутрішнього середовища, тощо.
Високу специфічність дії мають також білки, які становлять молекулярну основу таких процесів, як диференціювання і поділ клітин, розвиток живих організмів, що забезпечує їх біологічну індивідуальність. Маючи високу хімічну спорідненість, прості білки-протеїни можуть з'єднуватися з різними органічними сполуками, в результаті цього утворюються - складні білки — протеїди. Саме такі складні білки є основою будови клітин і субцелюлярних структур. Наприклад, хроматин ядра складається основним чином із нуклеопротеїдів, у склад яких входить ДНК. Рибосоми складаються із нуклеопротеїдів, у склад яких входить РНК, а біологічні мембрани містять ліпопротеїди. Сполучна тканина характеризується високим вмістом глікопротеїдів.
Більшість білків добре розчинні у воді. Однак деякі органічні речовини, виділені із хрящів, волосся, нігтів, рогів, кісткової тканини — нерозчинні в воді — також були віднесені до білків, оскільки за своїм хімічним складом виявилися близькими до білків м'язової тканини, сироватки крові.
Для вивчення хімічного складу, будови і властивостей білків їх виділяють із тканин або органів, наприклад, із сироватки крові, молока, м'язів, печінки, шкіри, волосся, шерсті. У результаті досліджень встановлено, що до складу білків входять такі елементи (%) : вуглець 50-55, водень - 6,5-7,3, азот - 15-17, кисень 21-23, сірка - 0,3-2,5. У складі білків виявлено також фосфор, залізо, марганець, магній, йод та інші. Оскільки в складі білків стабільним є вміст азоту (16%), то за його кількістю можна визначити вміст білків у тканинах і рідинах організму. Для цього отриману в результаті аналізу кількість азоту множать на коефіцієнт перерахунку (6,25), який одержують, виходячи з того, що масова частка азоту в більшості білків становить 16%; 100:16 = 6,25, тобто 6,25 - маса білка, що відповідає 1г азоту.
При повному кислотному, лужному або ферментативному гідролізі білків утворюються вільні амінокислоти. Їх класифікують в залежності від ознаки, яка лежить в основі їх поділу на групи. Прийнято три класифікації амінокислот: структурна – за будовою бічного радикала, електрохімічна – за кислотно-основними властивостями амінокислот, біологічна – за ступенем незамінності амінокислот для організму (рис. 6.1).

Вiдомо, що в природi зустрiчається приблизно 300 амiнокислот. Багато з них характерні лише для певних органiзмів.
Повний амiнокислотний склад бiлкiв був розшифрований в 30-х роках ХХ ст. Велика заслуга в цьому належить роботам М.Любавiна, який у 1871 роцi встановив, що пiд дiєю ферментiв травних сокiв бiлки розщеплються на амінокислоти, на підставі чого було зроблено два важливих висновки:
1) у склад бiлкiв входять амiнокислоти;
2) методами гiдролiзу може бути вивчений хiмiчний, зокрема амiнокислотний склад бiлкiв.
Хімічна структура і назви амінокислот представлені в таблиці 6.1.
Таблиця 6.1. Класифікація амінокислот
| Структурна формула | Назва | символ |
| І. Ациклічні амінокислоти 1. Аліфатичні незаміщені амінокислоти (моноаміномонокарбонові) | ||
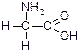
| Гліцин (глікокол), a-амінооцтова кислота | Глі |

| Аланін (a-амінопропіонова кислота) | Ала |

| Валін (a-аміноізовалер’янова кислота) | Вал |

| Лейцин (a-аміноізокапронова кислота) | Лей |
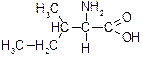
| Ізолейцин (a-аміно-b-метил-b-етилпропіонова кислота) | Іле |
| 2. Аліфатичні амінокислоти а. Гідроксіамінокислоти | ||

| Серин (a-аміно-b-гідроксипропіонова кислота) | Сер |

| Треонін (a-аміно-b-гідроксимасляна кислота) | Тре |
| б. Тіоамінокислоти | ||
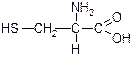
| Цистеїн (a-аміно-b-тіопропіонова кислота) | Цис |

| Цистин (ді-a-аміно-b-тіопропіонова кислота) | — |

| Метіонін (a-аміно-g-метилтіомасляна кислота) | Мет |
| в. Карбоксіамінокислоти (моноамінодикарбонові кислоти) | ||

| Аспарагінова (амінобурштинова) кислота | Асп |

| Глутамінова (a-аміноглутарова) кислота | Глу |

| Аспарагін (амід a-амінобурштинової кислоти) | Асн |
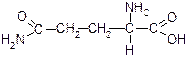
| Глутамін (d-амід a-аміноглутарової кислоти) | Глн |
| г. Діамінокислоти (діаміномонокарбонові кислоти) | ||

| Лізин (a,e-діамінокапронова кислота) | Ліз |
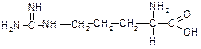
| Аргінін (a-аміно-d-гуанідиновалер’янова кислота) | Арг |
| ІІ. Циклічні амінокислоти 1. Ароматичні амінокислоти | ||
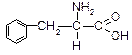
| Фенілаланін (a-аміно-b-фенілпропіонова кислота) | Фен |

| Тирозин (a-аміно-b-гідроксифенілпропіонова кислота) | Тир |
| 2. Гетероциклічні амінокислоти | ||

| Триптофан (a-аміно-b-індолілпропіонова кислота) | Трп або Три |
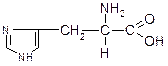
| Гістидин (a-аміно-b-імідазолілпропіонова кислота) | Гіс |
| 3. Циклічні імінокислоти | ||
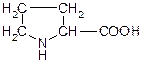
| Пролін (піролідин-a-карбонова кислота) | Про |
| ІІІ. Амінокислоти, що рідко зустрічаються в білках | ||
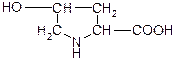
| Гідроксипролін (g-гідроксипіролідин-a-карбонова кислота) | Опр |

| Гідроксилізин (a,e-діаміно- δ-гідроксикапронова кислота) | — |
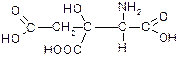
| Амінолимонна (a-аміно-b-гідрокси-b-карбоксиглутарова) кислота | ― |
Чим ближче амінокислотний склад білків їжі до амінокислотного складу білків організму, тим більша його біологічна цінність. Біологічна цінність білків тісно пов’язана із вмістом у них незамінних амінокислот. В організмі людини синтезується тільки 10 із 20 необхідних амінокислот. Вони можуть синтезуватись з продуктів обміну вуглеводів і ліпідів. Останні 10 амінокислот (лізин, лейцин, ізолейцин, треонін, фенілаланін, триптофан, метіонін, аргінін, гістидин, валін) не синтезуються в організмі, тому були названі есенціальними або незамінними.