 |
|
Митохондриальная наследственность
Митохондрии передаются с цитоплазмой яйцеклеток. Спермии не имеют митохондрий, поскольку цитоплазма элиминируется при созревании мужских половых клеток. В каждой яйцеклетке содержится около 25 000 митохондрий. Каждая митохондрия имеет кольцевую хромосому. Описаны мутации различных генов митохондрий. Генные мутации в митохондриальной ДНК обнаружены при атрофии зрительного нерва Лебера, митохондриальных миопатиях, доброкачественной опухоли (онкоцитоме), прогрессирующих офтальмоплегиях.
Митохондриальная наследственность имеет следующие признаки:
1. Болезнь передается только от матери.
2. Больны и девочки, и мальчики.
3. Больные отцы не передают болезнь ни дочерям, ни сыновьям.
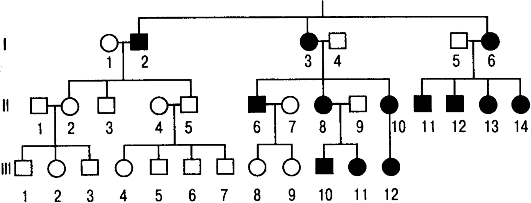
Родословная, иллюстрирующая передачу нейтрального признака через митохондрии (фрагмент ДНК).
Патогенез
Первичный биохимический дефект известен для нескольких сотен наследственных болезней. В большинстве случаев он проявляется усилением, или чаще ухудшением и даже полной утратой функции соответствующего белка. Наследственные дефекты ферментов (энзимопатии ) обычно приводят к снижению или полной утрате активности ферментов, участвующих в обмене (в основном в катаболизме) аминокислот, пуринов и пиримидинов, углеводов, липидов и других метаболитов. Известны также наследственные дефекты некоторых структурных белков, например, коллагенов; белков, участвующих в свертывании крови; белков системы комплемента; ряда транспортных белков, прежде всего, гемоглобинов; рецепторных белков; пептидных гормонов и некоторых др. Наследственный дефект того или иного белка, как правило, приводит к цепи сложных вторичных реакций, обусловленных нарушенным взаимодействием мутантного белка с другими белками и структурами целостного организма и формированию в конечном счете клинической картины наследственного заболевания. Для большинства наследственных болезней путь от мутантного гена к симптомам наследственной болезни остается неизвестным.
Распространенность
Распространенность наследственных болезней (встречаемость соответствующего заболевания в популяции) подчиняется популяционно-генетической закономерности. Встречаемость наследственных болезней в когорте (совокупность индивидов одного возраста в пересчете на новорожденных) называется частотой наследственных болезней. Значение частоты, как правило, оказывается выше, чем распространенности, так как оно учитывает возрастную зависимость начала заболевания и смерти.
Частота большинства наследственных болезней достаточно низкая, однако суммарно они составляют весьма заметный груз в популяции. По данным разных авторов, частота аутосомно-доминантных заболеваний составляет от 3 до 9,5, аутосомно-рецессивных — от 2 до 2,5 и Х-сцепленных рецессивных заболеваний — от 0,5 до 2 больных на 1000 новорожденных. Аутосомно-доминантные и Х-сцепленные рецессивные заболевания, резко снижающие приспособленность их носителей (ахондроплазия, миопатия Дюшенна и др.) встречаются с примерно одинаковой частотой с различных популяциях. Эта частота поддерживается за счет баланса между вновь возникающими мутациями и их элиминацией отбором через одно или два поколения. Аутосомно-рецессивные наследственные болезни, напротив, нередко обнаруживают неравномерное распределение по разным популяциям. Частота фенилкетонурии, например, которая выявляется у новорожденных во многих странах в течение 20 и более лет, варьируется от 1:6500 в Белоруссии, Чехии, Словакии и Польше до 1:210851 в Японии. Сходная вариабельность частот выявлена для галактоземии и некоторых других наследственных болезней. Хорошо известны примеры накопления отдельных аутосомно-рецессивных наследственных болезней не только в небольших изолированных популяциях, но и в значительных по численности этнических группах (накопление болезней Тея-Сакса, Нимана-Пика и Гоше и других болезней у евреев-ашкенази; аспартилгликозаминурии, диастрофической карликовости, лизинурической непереносимости белка и других болезней у финнов; семейной средиземноморской лихорадки у армян; синдрома холестаза-лимфатического отека у норвежцев и т. д.).
В большинстве случаев причиной накопления наследственных болезней в популяциях является дрейф генов, или такая его разновидность, как эффект родоначальника. В республиках Средней Азии и ряде других популяций накоплению аутосомно-рецессивных наследственных болезней в значительной степени способствуют кровнородственные браки. В некоторых случаях (- и -талассемия, серповидноклеточная анемия, недостаточность глюкозо-6-фосфатдегидрогеназы) накопление мутантных генов в популяциях, по-видимому, обусловлено наличием регионального фактора отбора (для указанных наследственных болезней — малярии) в пользу гетерозиготных носителей мутантного гена.
Диагностика
Диагноз ряда наследственных болезней, прежде всего тех, для которых неизвестен первичный биохимический или молекулярно-генетический дефект, основывается на результатах клинического обследования, спецификой которого является синдромологическая направленность. В диагностике наследственных болезней используется также клинико-генеалогический анализ с составлением родословной больного. По характеру родословной в ряде случаев можно сделать заключение о типе наследования заболевания. В диагностике наследственных болезней, в том числе дородовой, для которых известен первичный дефект, используются все современные биохимические, иммунологические, биофизические и другие методы анализа. Разработаны различные методы получения плодного материала для дородовой диагностики, в том числе амниотической жидкости с плодными клетками, ворсинок хориона и кусочков плаценты. Наследственные болезни, сопровождающиеся грубыми пороками развития, все чаще диагностируются пренатально при проведении ультразвукового обследования беременных женщин и плодов.
Все шире в диагностике наследственных болезней (особенно пренатальной) применяются молекулярно-генетические методы. В ряде случаев (например, при недостаточности антитромбина III, гемофилии А и В, фенилкетонурии, талассемии, муковисцидозе и др.) проводят прямой анализ мутантных генов с помощью так называемых молекулярных зондов или других методов. Для молекулярной диагностики наследственных болезней используют также непрямой подход с анализом сцепления разнообразных молекулярных (ДНК) маркеров с мутантной хромосомой. Некоторые наследственные болезни распознаются при сочетании нескольких методов ДНК-диагностики. В целом развитие методов молекулярно-генетического анализа идет быстрыми темпами.
Генетический скрининг
Особым видом помощи при наследственной патологии является скрининг новорожденных с помощью специальных биохимических тестов для своевременного досимптоматического выявления новорожденных с некоторыми наследственными болезнями обмена веществ, такими как фенилкетонурия, гипотиреоз и галактоземия с целью их последующего эффективного лечения. Во многих странах скрининг всех новорожденных для выявления фенилкетонурии был введен более 40 лет назад, а для гипотиреоза — несколько позже. С его помощью были выявлены многие тысячи потенциально больных новорожденных, которые получили соответствующее лечение (специальная диета без фенилаланина при фенилкетонурии, без галактозы при галактоземии и гормонотерапия при гипотиреозе), обеспечивающее их практическое выздоровление. Задачей скрининга новорожденных и других методов генетического скрининга является выявление носителей мутантных генов и последующее предупреждение рождения детей, больных наследственными болезнями.
Лечение и профилактика
Лечение моногенных наследственных болезней является либо патогенетическим (когда известен первичный биохимический дефект), либо симптоматическим (достаточно эффективно при ряде наследственных болезней, сопровождающихся врожденными пороками развития). Патогенетическое лечение в одних случаях связано с введением в организм недостающих продуктов мутантного гена (фактора VIII свертывания крови при гемофилии А, нормальных клеток, являющихся продуцентами нормальных ферментов при некоторых болезнях и т. д.). В других случаях оно сводится к исключению из продуктов питания патологически накапливающихся метаболитов — субстрата мутантного фермента (диета без фенилаланина при фенилкетонурии, без галактозы при галактоземии), или к введению больших доз кофакторов (например, витамина B6 при гомоцистинурии), восстанавливающих функции мутантного фермента, и т. д. В настоящее время эффективные методы лечения разработаны для примерно 30 наследственных болезней обмена веществ, а также для ряда других наследственных болезней.
Генная терапия, т. е. исправление дефекта на генном уровне с помощью введения чужеродной ДНК, содержащей нормальный ген, уже начала применяться для лечения наследственных болезней, но она еще далека от широкого практического применения.
Основным способом профилактики наследственных болезней является медико-генетическое консультирование. Оно направлено, как правило, на предупреждение появления новых случаев наследственных болезней в семьях и поэтому существенно не влияет на частоту наследственных болезней в популяции. Более эффективным методом профилактики наследственных болезней среди населения является выявление в популяции всех супружеских пар — носителей некоторых рецессивных генов с последующим осуществлением пренатальной диагностики заболевания у плода (проводится при серповидноклеточной гемоглобинопатии, -талассемии в ряде стран, болезни Тея-Сакса среди евреев-ашкенази в США) либо массовое обследование беременных женщин с целью пренатальной диагностики различных врожденных пороков развития.