 |
|
Методика построения диаграмм Пурбе
КУРСОВАЯ РАБОТА
по дисциплине «Теория электрометаллургических процессов»
на тему «Построение диаграммы Пурбе для системы олово-вода»
Выполнил студент группы МЦ-10-1 ______________Федоров С. Н.
Курсовая работа защищена с оценкой _______________________________
Иркутск 2012 г.
Оглавление
ЗАДАНИЕ НА КУРСОВУЮ РАБОТУ.. 3
Введение. 4
Методика построения диаграмм Пурбе. 7
Диаграмма Пурбе для системы олово-вода. 10
Заключение. 11
Список литературы.. 12
Министерство образования и науки Российской Федерации
Федеральное агентство по образованию
ИРКУТСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
ЗАДАНИЕ НА КУРСОВУЮ РАБОТУ
По курсу «Теория электрометаллургических процессов»___________
Студенту_____________________Федорову С. Н.__________________________
(фамилия, инициалы)
Тема работы_______Построение диаграммы Пурбе для системы олово-вода ___
_____________________________________________________________________Исходные данные расчет и построение диаграммы Пурбе для системы Sn-вода при наличии фаз:Snмет, Sn2+, [SnOH]+, Sn(OH)2, [Sn(OH)3]-____________________________________________________________
Рекомендуемая литература_________________________________________
Минеев Г.Г., Минеева Т.С., Жучков И.А., Зелинская Е.В. Теория металлургических процессов: учебник / под общ. ред. Г.Г. Минеева. Иркутск: Изд-во ИрГТУ, 2010. – 524с.
Электрохимия : учеб. Б. Б. Дамаскин, О. А. Петрий, Г. А. Цирлина. – 2-е изд., испр. и перераб . – М.: КолосС, 2008. – 669 с.
Краткий справочник физико-химических величин. 11-е издание, испр. и дополн. / Под ред. А.А. Равделя и А.М. Пономаревой – М. ООО «ТИД «Аз-book», 2009. – 240 с. _
____________________________________________________________________________________________________________________________________________________________________________________________________________
Графическая часть на _ _–___ листах.
Дата выдачи задания «25» сентября 2012г.
Дата представления работы руководителю «14» декабря 2012г.
Руководитель курсовой работы доцент, к.х.н. М. Ю. Кузьмина__________
Введение
Все химические процессы, как правило, обратимы. При протекании обратимой химической реакции пА + тВ ↔ rG + qD по закону действующих масс скорость процесса в прямом направлении (слева направо) определяется как W1 = К1 ·  ·
·  , а в обратном направлении (справа налево) – как W2 = К2 ·
, а в обратном направлении (справа налево) – как W2 = К2 ·  ·
·  . В этих выражениях
. В этих выражениях  ,
, 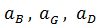 - активности соответствующих компонентов (А, В, G, D). Показатели степени п, т, r, q (стехиометрические коэффициенты при соответствующих членах реакции) называютсяпорядком реакции по данному компоненту. Коэффициенты пропорциональности K1 и К2 имеют названиеконстант скорости реакции в соответственно в прямом и в обратном направлениях. Константа скорости реакции численно равна скорости реакции при единичных концентрациях реагирующих компонентов. Отношение К1/К2 - Кр называется "константой равновесия" химического процесса.
- активности соответствующих компонентов (А, В, G, D). Показатели степени п, т, r, q (стехиометрические коэффициенты при соответствующих членах реакции) называютсяпорядком реакции по данному компоненту. Коэффициенты пропорциональности K1 и К2 имеют названиеконстант скорости реакции в соответственно в прямом и в обратном направлениях. Константа скорости реакции численно равна скорости реакции при единичных концентрациях реагирующих компонентов. Отношение К1/К2 - Кр называется "константой равновесия" химического процесса.
В момент равновесия скорости реакции в прямом и в обратном направлениях уравниваются: W1 = К1 ·  ·
·  = W2 = К2 ·
= W2 = К2 ·  ·
·  . Отсюда можно определить значение константы равновесия химического процесса: Кр = К1/К2 =
. Отсюда можно определить значение константы равновесия химического процесса: Кр = К1/К2 =  ·
·  /
/  ·
·  ), которое может быть найдено и расчетным путем по известным выражениям термодинамических функций веществ, участвующих в реакции: по изменению энергии Гиббса ΔG°, теплосодержания (энтальпии) ΔН° и энтропии ΔS0. Изменение энергии Гиббса рассчитывается с учетом схемы процесса и табличных значений изобарно-изотермического потенциала участников реакции. Например, при электролизе сернокислого цинка на катоде протекает процесс восстановления ионов цинка: Zn2+ + 2е = Zn°, а на аноде - окисление кислорода воды: Н2О – 2е = 2Н+ + 1/2О2. Поэтому суммарный окислительно - восстановительный процесс выражается следующей реакцией: Zn2+ + Н2О = Zn° + + 2Н++ 1/2О2.
), которое может быть найдено и расчетным путем по известным выражениям термодинамических функций веществ, участвующих в реакции: по изменению энергии Гиббса ΔG°, теплосодержания (энтальпии) ΔН° и энтропии ΔS0. Изменение энергии Гиббса рассчитывается с учетом схемы процесса и табличных значений изобарно-изотермического потенциала участников реакции. Например, при электролизе сернокислого цинка на катоде протекает процесс восстановления ионов цинка: Zn2+ + 2е = Zn°, а на аноде - окисление кислорода воды: Н2О – 2е = 2Н+ + 1/2О2. Поэтому суммарный окислительно - восстановительный процесс выражается следующей реакцией: Zn2+ + Н2О = Zn° + + 2Н++ 1/2О2.
Изменение энергии Гиббса этого процесса при стандартной температуре составляет
 = –
= –  –
–  = – ( –147) – (– 237) = 384 кДж/моль.
= – ( –147) – (– 237) = 384 кДж/моль.
Изменение энергии Гиббса с изменением энтальпии и энтропии связано уравнением Гиббса - Гельмгольца: ΔGT = ΔНТ – T.ΔST . Значение ΔGT может быть рассчитано, если известны стандартные величины  и
и  и зависимости изменения теплоемкостей реагирующих веществ от температуры. Отметим, что теплоемкость при постоянном объеме системы (Cv) или постоянном давлении (Ср) – это количество тепла dQ, которое надо передать единице вещества (грамму, грамм-молю), чтобы его температура поднялась на один градус: С(v, p) = dQ/dT. Изменение энтальпии и энтропии с изменением температуры имеет вид:
и зависимости изменения теплоемкостей реагирующих веществ от температуры. Отметим, что теплоемкость при постоянном объеме системы (Cv) или постоянном давлении (Ср) – это количество тепла dQ, которое надо передать единице вещества (грамму, грамм-молю), чтобы его температура поднялась на один градус: С(v, p) = dQ/dT. Изменение энтальпии и энтропии с изменением температуры имеет вид:
 =
=  +
+ 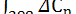 . dT и
. dT и  =
=  +
+  . dT. Поэтому
. dT. Поэтому
 =
=  – T . ΔS298 –
– T . ΔS298 –  . dT) .
. dT) . 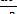 . Последний член этого уравнения представляет собой поправку на отклонение
. Последний член этого уравнения представляет собой поправку на отклонение  и
и  от стандартных значений. Рассчитанные величины этих поправок можно взять из специальных таблиц, предложенных М. М. Темкиным и Л. А. Шварцманом. Эти таблицы есть во многих изданиях по физической химии.
от стандартных значений. Рассчитанные величины этих поправок можно взять из специальных таблиц, предложенных М. М. Темкиным и Л. А. Шварцманом. Эти таблицы есть во многих изданиях по физической химии.
Связь между константой равновесия Кр и энергией Гиббса  при температуре Т выражается соотношением
при температуре Т выражается соотношением  = –2,3RT . lg(Kp). Отсюда для рассматриваемого процесса значение логарифма константы равновесия при температуре 20 °С (293К) составляет lg(Kp)=
= –2,3RT . lg(Kp). Отсюда для рассматриваемого процесса значение логарифма константы равновесия при температуре 20 °С (293К) составляет lg(Kp)= 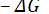 /(2,3RT ) = – 384000/(2,3 . 8,314 . 293) = – 68,5. Следовательно, Кр = 10–68,5. При больших отрицательных значениях
/(2,3RT ) = – 384000/(2,3 . 8,314 . 293) = – 68,5. Следовательно, Кр = 10–68,5. При больших отрицательных значениях  (< – 40 кДж/моль) константа равновесия процесса Кр очень велика, и реакция почти необратима. Большое положительное значение
(< – 40 кДж/моль) константа равновесия процесса Кр очень велика, и реакция почти необратима. Большое положительное значение  (> + 40 кДж/моль) указывает на то, что без удаления одного из продуктов реакции процесс в обычных условиях не идет (Кр очень мала). Например, при температуре 298 К и
(> + 40 кДж/моль) указывает на то, что без удаления одного из продуктов реакции процесс в обычных условиях не идет (Кр очень мала). Например, при температуре 298 К и  = + 40 кДж/моль lg(Kp) = - 40000/(2,3 . 8,314 . 298) = –7 и Кр = 10–7. В рассмотренном выше примере Кр = 10–68,5, что свидетельствует о том, что осуществить процесс против термодинамической направленности можно только при использовании внешней электрической энергии.
= + 40 кДж/моль lg(Kp) = - 40000/(2,3 . 8,314 . 298) = –7 и Кр = 10–7. В рассмотренном выше примере Кр = 10–68,5, что свидетельствует о том, что осуществить процесс против термодинамической направленности можно только при использовании внешней электрической энергии.
Если в системе протекает окислительно-восстановительный процесс, то основной характеристикой равновесия в этом процессе является электрохимический потенциал реакции. Потенциал каждого из участников реакции относительно стандартного водородного электрода определяется выражением (В): ε = ε0 + RT/(nF) – ln(aокисл./aвосст.), которое при 25 °С принимает вид ε = ε0 + + 0,059 . п . lп(аокисл./авосст.).
Предположим, рассматриваем процесс Авосст.+ Вокисл. = Ввосст.+ Аокисл.. Здесь протекают две реакции: Авосст. - пе = Аокисл. и Вокисл. + пе = Ввосст.. Для всего этого процесса потенциал определяется какЭДС элемента (определяемая как разность потенциалов участников процесса):
ε2 – ε1 = (  –
–  ) +
) +  –
–  =
=
= (  –
–  ) +
) +  .
.
Ho, как отмечено выше, отношение  = KP, а разность (
= KP, а разность (  –
–  )= E˚ – стандартная величинаЭДС . Поэтому в момент равновесия реакции E˚ = 2,3RT/(n · F) · lg(Кр). Но, как показано ранее, 2,3RT · lg(Kp) = –ΔG˚. Следовательно, Е˚ = – ΔG°/(nF), то есть потенциал процесса можно определить во величине его энергии Гиббса и числу электронов, участвующих в реакции. Поэтому для рассмотренного выше окислительно-восстановительного процесса электролитического разложения сернокислого цинка Е° = – [– 384000/(2 · 96500)] = 1,99 В.
)= E˚ – стандартная величинаЭДС . Поэтому в момент равновесия реакции E˚ = 2,3RT/(n · F) · lg(Кр). Но, как показано ранее, 2,3RT · lg(Kp) = –ΔG˚. Следовательно, Е˚ = – ΔG°/(nF), то есть потенциал процесса можно определить во величине его энергии Гиббса и числу электронов, участвующих в реакции. Поэтому для рассмотренного выше окислительно-восстановительного процесса электролитического разложения сернокислого цинка Е° = – [– 384000/(2 · 96500)] = 1,99 В.
Для графического изображения равновесия электрохимических процессов, протекающих в водной среде, удобны диаграммы зависимости ε =f(pH), называемые диаграммами Пурбе, получившие широкое применение главным образом благодаря работам Пурбе и его школы. При построении этих диаграмм поле диаграммы прежде всего разбивают на три области, нанося на него линии восстановления водорода и окисления кислорода при электролитическом разложении воды, а уже затем рассчитывают области существования различных фаз рассматриваемого процесса. Устойчивость тех или иных фаз будет определяться их месторасположением в поле диаграммы: фазы, находящиеся ниже линии восстановления водорода, способствуют разложению воды с выделением газообразного Н2, а фазы, находящиеся выше линии окисления кислорода, способствуют разложению воды с выделением газообразного О2.
Диаграммы Пурбе дают обоснование некоторых возможных методов защиты металлов от коррозии. Из диаграммы также следует, что при повышении рН до известных пределов начинается образование новых твердых неметаллических фаз, которые, возникая на поверхности металла, могут защищать его от коррозии и переводить в состояние пассивности.
При использовании диаграмм Пурбе необходимо иметь в виду, что основанные на них выводы являются лишь термодинамически наиболее вероятными; они указывают на термодинамическую возможность или невозможность того или иного процесса. В реальных условиях не исключены отклонения от сделанных выводов и протекающие процессы могут быть из-за кинетических ограничений иными, чем те, которые следуют из общих термодинамических соотношений.
Методика построения диаграмм Пурбе
В данной курсовой работе рассматривается методика построения диаграммы Пурбе на примере олово металлический – вода. При построении диаграммы необходимо рассмотреть условия термодинамического равновесия между ионами в растворе, ионами и твердыми фазами и между самими твердыми фазами в присутствии воды. И для этого необходимо знать энергию Гиббса всех участников системы.
1) Рассчитаем равновесие между Snмет и Sn2+ по химической реакции:
Sn2+ + 2e ↔ Snмет
ΔG 0 = G 0Sn2+ = -27 кДж/моль
ε0 = ΔG O/ nF = -27000/2 ∙96500 = -0,14 В
ε = ε0 + (0,059/2) ∙ lg (a Sn2+ ) = ε0 - 0,059∙рН
Потенциал данного перехода является линейной функцией активности катионов Sn2+, то есть каждому значению активности ионов свинца в растворе, находящихся в равновесии с металлом, соответствует свое значение потенциала окислительного процесса. При этом потенциал данной реакции не зависит от pH среды.
Если a Sn2+ = 1 ∙ (lg(a Sn2+) = 0), то ε = ε0 = -0,14В
2) Рассчитаем равновесие между твердыми фазами Snмет и Sn(OH)2 по химической реакции
Snмет + 2H2O ↔Sn (OH)2 + 2H + +2e
ΔG 0 = G 0 Sn(OH)2 - 2G 0H2O = -464 + 2∙237 = 10 кДж/моль
ε0 = ΔG˚/ nF = 10000/2 ∙96500 = 0.05 В
ε = ε0 + (0.059/2) ∙lg (a 2H+ ) = ε0 - 0,059∙рН
εrpH=0 = 0.05 В
εrpH=14= 0.11 – 0,059∙14 = -0.116 В
3) Рассчитаем равновесие между ионами Sn2+ и гидроксидом Sn(OH)2 тв по химической реакции:
Sn2+ + 2H2O ↔ Sn(OH)2 + 2H+
ΔG0 = G0 Sn(OH)2 - G0 Sn2+ – 2G0H2O = -464 + 27 + 2 ∙237 = 37кДж/моль
lg(Kp ) = lg(a 2H+ / a Sn2+) = -ΔG 0/2,3 RT = -37000/2,3 ∙ 8,314 ∙298 = -6.49
lg(a Sn2+) = 6.49 - 2pH
Если a Sn2+ = 1, (lg(a Sn2+) = 0), то pH = 6,49/2 = 3.25
рН = 3.25
4) Рассчитаем равновесие между ионами Sn2+ и [Sn(OH)]+:
Sn2+ + H2O ↔ [Sn(OH)]+ + H+
ΔG 0 = G 0Sn(OH)]+ - G 0 Sn2+ - G 0H2O = -252 + 27 + 237 = 12 кДж/моль
lg(kp ) = lg( a [Sn (OH)]+ ∙ aH+ / a Sn 2+) = -ΔG 0/2,3 RT = -12000 / 2,3 ∙8,314∙298 = –2,10
lg(a [Sn(OH)]+ / a Sn2+) = –2,10 + рН
lg(a [Sn(OH)]+ / a Sn2+) = 0
рН = 2,10
При этом расчете у нас получается что фаза Sn(OH)+ смещается в область ионов Sn2+ , а это не возможно, т.е. этой фазы не будет.
5) Рассчитаем равновесие между ионами Sn2+ и [Sn(OH)3 ]-
Sn2+ + 3H2O ↔ [Sn(OH)3 ]- + 3H+
ΔG 0 = G 0[Sn(OH)3] - - G 0 Sn 2+ - 3G 0H2O = -646 + 27 + 3 ∙ 237= 65 кДж/моль
lg(kp ) = lg( a[Sn(OH)3] - a 3H+ / a Pb2+) = -ΔG0/2,3 RT = -65000/2,3 ∙8,314 ∙298 = -11,4
lg(a [Sn(OH)3] - / a Pb2+) = -11,4 + 3pH
lg(a [Sn(OH)3] - / a Pb2+) = 0
pH = 3,8
При этом расчете у нас получается что фаза [Sn(OH)3 ]- смещается в область ионов Sn2+ , а это не возможно, т.е. этой фазы не будет.