 |
|
Дисциплина «Биотехнология микроорганизмов»
Дисциплина «Органическая и биоорганическая химия»
Основные положения теории химического строения А.М.Бутлерова. Классификация и номенклатура органических соединений: тривиальные, рациональные, систематические названия. Современная заместительная номенклатура ИЮПАК. Углерод, электронная конфигурация; гибридизация углерода в органических соединениях.
Воснову научной классификации и номенклатуры органических соединений положены принципы теории химического строения А. М. Бутлерова.
Все органические соединения подразделяют на следующие основные ряды:
I. Ациклические соединения— с открытой цепью углеродных атомов (их называют также алифатическими соединениями, или соединениями жирного ряда):
1. Предельные (насыщенные).
2. Непредельные (ненасыщенные).
II. Циклические соединения— с замкнутой в кольцо цепью атомов.
1. Карбоциклические (изоциклические),— в кольцевую систему которых входят только углеродные атомы:
а) алициклические (предельные и непредельные), б) ароматические.
2. Гетероциклические соединения — в их кольцевую систему, кроме углеродных атомов, входят атомы других элементов — гетероатомы (кислород, азот, сера и т. д.).
В рядах ациклических икарбоциклических соединений основными классами являются углеводороды.
В основе гетероциклических соединений лежат гетероциклы, в которых атомы, образующие кольцо, соединены только с атомами водорода.
В предельных (насыщенных) углеводородах атомы углерода соединены друг с другом простыми (ординарными) связями С—С. В непредельных (ненасыщенных) углеводородах имеются одна или несколько пар углеродных атомов, соединенных кратными — двойными С = С или тройными С ≡ С связями.
Углеводороды с двойными или тройными связями могут быть образованы путем отнятия 2, 4, 6 и более атомов водорода от пар смежных углеродных атомов в предельных углеводородах; при этом получаются непредельные углеводороды, содержащие соответственно двойную, тройную, две двойные ит. д. связи. При отнятии же двух и более атомов водорода от несмежных углеродных атомов из предельных ациклических углеводородов могут быть получены циклические углеводороды.
Таким образом, все другие углеводороды можно рассматривать как производные предельных ациклических углеводородов.
Несколько кратных связей могут иметь различное взаимное расположение в углеродной цепи. Например, различают кумулированные С = С = С, сопряженные (или конъюгированные) С = С—С = С и изолированные (или уединенные)С = С—(СН2)п—С = С двойные связи.Углеводороды различных классов образуют так называемые гомологические ряды, в которых каждый последующий углеводород отличается от предыдущего члена ряда на гомологическую разность СН2. Состав любого члена гомологического ряда выражается общей для данного ряда эмпирической формулой. Например, состав ациклических предельных углеводородов может быть представлен формулой СnН2n+2, непредельных — с одной двойной связью CnH2n, — с одной тройной или с двумя двойными связями СnН2n – 2 и т. д. Например:
Названия гомологических рядов углеводородов иногда производят от названий их простейших членов, например: углеводороды ряда метана, углеводороды ряда этилена (этиленовые углеводороды), углеводороды ряда ацетилена (ацетиленовые углеводороды).
При замещении в углеводородах того или иного гомологического ряда одного или нескольких атомов водорода отдельными атомами или группами (например, галогенами, группами —NO2, —ОН, —NH2 и т. д.) образуются гомологические ряды, соответственно, галогенпроизводных, нитросоединений, спиртов, аминов и т. д. Таким образом, все другие классы органических соединений того или иного ряда являются производными углеводородов.
Для наименования отдельных органических соединений широкое распространение получили тривиальные названия, рациональная, Женевская (1892 г.) и Льежская (1930 г.) номенклатуры. Среди них наиболее строгой с точки зрения единого принципа наименования органических соединений и однозначности их названий (особенно для ациклических соединений) является Женевская номенклатура. К сожалению, она в свое время не была разработана полностью и не может быть использована как единственная при наименовании очень многих сложных органических соединений.
В 1947 г. на совещании Международного союза чистой и прикладной химии (International Union of Pure and Applied Chemistry — сокращенно IUPAC), состоявшемся в Лондоне, было принято решение о пересмотре существовавших правил номенклатуры органических соединений и о выработке новых международных правил. Созданная комиссия выработала правила, которые в 1957 г. были опубликованы под названием Правила номенклатуры органических соединений IUPAC 1957.
В СССР А. П. Терентьевым с сотрудниками (1951 г.) была предложена систематическая номенклатура,основанная на строгом едином принципе и позволяющая однозначно называть любое органическое соединение. Однако эта номенклатура, вследствие довольно значительного отличия от обычных привычных химикам названий, не является общепринятой.
Ниже дана краткая характеристика различных номенклатурных систем.
Тривиальные названия не вытекают из каких-либо единых систематических принципов номенклатуры; они не выражают строения соединения и обычно отражают историю, происхождение веществ, выделение их из природных продуктов, путь синтеза и т. п. (например, рудничный газ, муравьиная кислота, винный спирт, бензол, ванилин, стрептоцид). Многие соединения названы по имени ученого, открывшего их (кетон Михлера, углеводород Чичибабина и т. п.). Однако и некоторые тривиальные названия приведены в известную систему. Так, в ряду метана все названия углеводородов, начиная от C5, являются систематическими — корни их производятся от греческих числительных, и все они имеют общее окончание -ан (пентан, гексан, гептан) и т. д.; названия же первых четырех представителей этого ряда (метан, этан, пропан, бутан) — тривиальные, так как корни их не образованы по какой-либо системе, однако и эти названия имеют общее для ряда метана окончание -ан. Такие названия по номенклатуре IUPAC обозначаются как полутривиальные или полусистематические (semi-trivial и semi-sistematic).
Рациональная и другие упомянутые номенклатуры построены на принципах научной систематики органических соединений: название соединения должно отражать его химическое строение.По рациональной номенклатуре за основу наименования органического соединения обычно принимают название наиболее простого (чаще всего первого) члена данного гомологического ряда. Все остальные соединения рассматривают как производные этого простейшего гомолога, образованные замещением в нем атомов водорода углеводородными или иными радикалами, атомами или атомными группами.
Углерод (С) – типичный неметалл; в периодической системе находится в 2-м периоде IV группе, главной подгруппе. Порядковый номер 6, Ar = 12,011 а.е.м., заряд ядра +6. Физические свойства: углерод образует множество аллотропных модификаций: алмаз – одно из самых твердых веществ, графит, уголь, сажа. Химические свойства: электронная конфигурация: 1s22s22p2. На электронной оболочке атома – 6 электронов; на внешнем валентном уровне – 4 электрона. Наиболее характерные степени окисления: +4, +2 – в неорганических соединениях, – 4, -2 – в органических. Углерод в любом гибридном состоянии способен использовать все свои валентные электроны и орбитали. У 4-валентного углерода нет неподеленных электронных пар и нет свободных орбиталей – углерод химически относительно устойчив.
Карбоновые кислоты. Классификация. Физические и химические свойства. Получение, применение. Основные представители: Муравьиная, уксусная, фумаровая, малеиновая, акриловая, коричная, олеиновая кислоты.
Карбо́новые кисло́ты — класс органических соединений, молекулы которых содержат одну или несколько функциональных карбоксильных групп -COOH. Кислые свойства объясняются тем, что данная группа может сравнительно легко отщеплять протон. За редкими исключениями карбоновые кислоты являются слабыми. Например, у уксусной кислоты CH3COOH константа кислотности равна 1,75·10−5. Ди- и трикарбоновые кислоты более сильные, чем монокарбоновые.
В зависимости от радикала, связанного с карбоксилом, различают следующие группы карбоновых кислот:ароматические,алифатические (в том числе предельные и непредельные),алициклические гетероциклические.По числу карбоксильных групп кислоты могут быть одно-, двух- и многоосновными. При введении в молекулы кислоты других функциональных групп (например, -ОН, =CO, -NH2 и др.) образуются окси-, кето-, аминокислоты и другие классы соединений.Муравьиная кислота – в медицине - муравьиный спирт (1,25% спиртовой раствор муравьиной кислоты), в пчеловодстве, в органическом синтезе, при получении растворителей и консервантов; в качестве сильного восстановителя.
Уксусная кислота – в пищевой и химической промышленности (производство ацетилцеллюлозы, из которой получают ацетатное волокно, органическое стекло, киноплёнку; для синтеза красителей, медикаментов и сложных эфиров). В домашнем хозяйстве как вкусовое и консервирующее вещество.
Масляная кислота – для получения ароматизирующих добавок, пластификаторов и флотореагентов.
Щавелевая кислота – в металлургической промышленности (удаление окалины).
Стеариновая C17H35COOH и пальмитиновая кислота C15H31COOH – в качестве поверхностно-активных веществ, смазочных материалов в металлообработке.
Олеиновая кислота C17H33COOH – фотореагент и собиратель при обогащении руд цветных металлов.
Карбоновые кислоты - исходные соединения для получения промежуточных продуктов органического синтеза, в частности кетенов, галогенангидридов, виниловых эфиров, галогенкислот. Соли карбоновых кислот и щелочных металлов применяют как мыла, эмульгаторы, смазочные масла; соли тяжелых металлов - сиккативы, инсектициды и фунгициды, катализаторы. Эфиры кислот - пищевые добавки, растворители; моно- и диэфиры гликолей и полигликолей пластификаторы, компоненты лаков и алкидных смол; эфиры целлюлозы - компоненты лаков и пластмассы. Амиды кислот эмульгаторы и флотоагенты.
Окисление спиртов
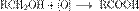
Окисление альдегидов

Гидролиз тригалогеналканов

Карбоксилирование металлорганических соединений


Гидролиз сложных эфиров

Гидролиз нитрилов


Катализируется кислотой или основанием; первоначально образуется амид, который гидролизуется до кислоты; лишь в редких случаях амид устойчив к гидролизу; удобный лабораторный метод (если нитрил доступен)
Реакция Арндта-Эйстерта


Используется для получения высших гомологов кислот из низших
Низшие карбоновые кислоты — жидкости с острым запахом, хорошо растворимые в воде. С повышением относительной молекулярной массы растворимость кислот в воде и их плотность уменьшаются, а температура кипения повышается. Высшие кислоты, начиная с пеларгоновой (н-нонановой) СН3-(СН2)7-СООН, — твердые вещества, без запаха, нерастворимые в воде. Низшие карбоновые кислоты в безводном виде и в виде концентрированных растворов раздражают кожу и вызывают ожоги, особенно муравьиная кислота и уксусная кислота.
На физических свойствах карбоновых кислот сказывается значительная степень ассоциации вследствие образования водородных связей. Кислоты в отличие от спиртов, образуют более прочные водородные связи, вследствие того что связи  в них в большей степени поляризованы по типу
в них в большей степени поляризованы по типу  Кроме того, у карбоновых кислот имеется возможность образования водородных связей с кислородом карбонильного диполя, обладающим значительной электроотрицательностью, а не только с кислородом другой гидроксильной группы. Действительно, в твердом и жидком состояниях карбоновые кислоты существуют в основном в виде циклических димеров
Кроме того, у карбоновых кислот имеется возможность образования водородных связей с кислородом карбонильного диполя, обладающим значительной электроотрицательностью, а не только с кислородом другой гидроксильной группы. Действительно, в твердом и жидком состояниях карбоновые кислоты существуют в основном в виде циклических димеров
Дисциплина «Биотехнология микроорганизмов»
4.Биометаногенез, стадии и микроорганизмы, его осуществляющие. Способы производства биогаза.
Биогаз — это смесь из 65 % метана, 30 % СО2, 1 % сероводорода и незначительных примесей азота, кислорода, водорода и угарного газа. Энергия, заключенная в 28 м3 биогаза, эквивалентна энергии: 16,8 м3 природного газа; 20,8 л нефти; 18,4 л дизельного топлива. В основе получения биогаза лежит процесс метанового брожения, или биометаногенез — процесс превращения биомассы в энергию. Биометаногенез — сложный микробиологический процесс, в котором органическое вещество разлагается до диоксида углерода и метана в аэробных условиях. Микробиологическому анаэробному разложению поддаются практически все соединения природного происхождения, а также значительная часть ксенобиотиков органической природы. В анаэробном процессе биометаногенеза выделяют три последовательные стадии, в которых участвуют свыше 190 различных микроорганизмов. На первой стадии под влиянием экстрацеллюлярных ферментов ферментативному гидролизу подвергаются сложные многоуглеродные соединения — белки, липиды и полисахариды. Вместе с гидролитическими бактериями функционируют и микроорганизмы — бродильщики, которые ферментируют моносахариды, органические кислоты. На второй стадии (ацидогенез) в процессе ферментации участвуют две группы микроорганизмов: ацетогенные и гомоацетатные. Ацетогенные Н2-продуцирующие микроорганизмы ферментируют моносахариды, спирты и органические кислоты с образованием Н2, СО2, низших жирных кислот, в основном ацетата, спиртов и некоторых других низкомолекулярных соединений. Деградация бутирата, пропионата, лактата с образованием ацетата происходит при совместном действии ацетогенных Н2-продуцирующих и Н2-утилизирующих бактерий. Гомоацетатные микроорганизмы усваивают Н2 и СО2, а также некоторые одноуглеродные соединения через стадию образования ацетил-КоА и превращения его в низкомолекулярные кислоты, в основном в ацетат. На заключительной третьей стадии анаэробного разложения отходов образуется метан. Он может синтезироваться через стадию восстановления СО2 молекулярным водородом, а также из метильной группы ацетата. Некоторые метановые бактерии способны использовать в качестве субстрата формиат, СО2, метанол, метиламин и ароматические соединения:. Первую стадию разрушения сложных органических полимеров осуществляют бактерии из родов Clostridium, Bacteroides, Ruminococcus, Butyrivibro. Главные продукты ферментации — ацетат, пропионат, сукцинат, Н2 и СО2. Конечными продуктами ферментации целлюлозы и гемицеллюлозы под действием бактерий, выделенных из рубца жвачных и кишечника свиней, являются различные летучие жирные кислоты. Бактерии второй, или ацетогенной, фазы, относящиеся к родам Syntrophobacter, Syntrophomonas и Desulfovibrio, вызывают разложение пропионата, бутирата, лактата и пирувата до ацетата, Н2 и СО2 — предшественников метана. Ряд микроорганизмов способны синтезировать ацетат из СО2 в термофильных условиях, к их числу принадлежат Clostridium formicoaceticum, Acetobacterium woodii, метановые бактерии из родов Methanothrix, Methanosarcina, Methanococcus, Methanogenium и Methanospirillum. Для получения биогаза можно использовать отходы сельского хозяйства, испорченные продукты, стоки крахмалперерабатывающих предприятий, жидкие отходы сахарных заводов, бытовые отходы, сточные воды городов и спиртовых заводов.. В настоящее время для производства биогаза чаще используют вторичные отходы (отходы животноводства и сточные воды городов), чем первичные (отходы зерноводства, полеводства, хлопководства, пищевой, легкой, микробиологической, лесной и других отраслей), обладающие сравнительно низкой реакционной способностью и нуждающиеся в предварительной обработке.
Способы производства белков одноклеточных организмов, бактериальных препаратов для защиты и удобрения растений, органических кислот и нейтральных продуктов, полисахаридов, аминокислот, ферментов и антибиотиков.
Первый в мире крупный завод кормовых дрожжей мощностью 70000 т в год был пущен в 1973 г. в СССР. В качестве сырья на нем использовали выделенные из нефти н-алканы, а продуцентами стали несколько видов дрожжей, способных к быстрому росту на углеводородах: Candida maltosa, Candida guilliermondii, Candida lipolytica.
Были подробно изучены специфические особенности окисления и ассимиляции углеводородов, кинетические параметры роста, разработана технология их культивирования в крупных ферментерах объемом в сотни кубических метров. Однако в последующем масштабы производства дрожжевого белка на углеводородах нефти резко сократились. Это произошло как в результате экономического кризиса 1990-х гг., так и из-за целого ряда специфических проблем, с которыми связано это производство. Одна из них - необходимость очистки готового кормового продукта от остатков нефти, имеющих канцерогенные свойства. Другим пригодным видом сырья для производства микробного белка является метанол. На метаноле как на единственном источнике углерода и энергии способны расти около 25 видов дрожжей, в том числе Pichia polymorpha, Pichia anomala, Yarrowia lipolytica. Однако более выгодным считается выращивание на метаноле метилотрофных бактерий, таких как Methylophilus methylotrophus, так как они используют одноуглеродные соединения более эффективно. Поэтому при росте на метаноле бактерии дают больше биомассы, чем дрожжи. Первая реакция окисления метанола у дрожжей катализируется оксидазой, а у метилотрофных прокариот - дегидрогеназой. Ведутся генноинженерные работы по переносу гена метанолдегидрогеназы из бактерий в дрожжи. Это позволит объединить технологические преимущества дрожжей с эффективностью роста бактерий. В последнее время интенсивно изучаются дрожжи, обладающие гидролитическими ферментами и способные расти на полисахаридах без их предварительного гидролиза. Использование таких дрожжей позволит избежать дорогостоящую стадию гидролиза полисахаридсодержащих отходов. Известно более 100 видов дрожжей, которые хорошо растут на крахмале как на единственном источнике углерода. Среди них особенно выделяются два вида, которые образуют как глюкоамилазы, так и a-амилазы, растут на крахмале с высоким экономическим коэффициентом и могут не только ассимилировать, но и сбраживать крахмал: Schwanniomyces occidentalis и Saccharomycopsis fibuliger. Оба вида - перспективные продуценты белка и амилолитических ферментов на крахмалсодержащих отходах. Промышленно важные органические кислоты, продуцируемые микроорганизмами, являются либо конечными продуктами (молочная, масляная, пропионовая кислоты у анаэробных бактерий), либо интермедиатами метаболизма, которые можно получать с помощью дрожжей. В больших масштабах производится лимонная кислота, в основном с помощью Aspergillus niger, с использованием в качестве субстрата мелассы. Однако ее можно получать и с помощью дрожжей Yarrowia lipolytica на более дешевых субстратах, таких как парафины нефти. Сейчас разработаны технологии получения и многих других кислот, например, изолимонной из Candida catenulata, фумаровой из Candida hydrocarbofumarica, яблочной из Pichia membranaefaciens и др.
Из дрожжевых полисахаридов наиболее популярен пуллулан, который получают из дрожжеподобного гриба ^ Aureobasidium pullulans. Он представляет собой b-глюкан, в котором мальтотриозные остатки соединены между собой b (1®6)-гликозидными связями. Пуллулан используется в основном в пищевой промышленности в качестве пленочного покрытия. Возможно получение разнообразных по строению и свойствам полисахаридов и из других видов дрожжей. Особенно много внеклеточных полисахаридов образуют дрожжи Cryptococcus, Rhodotorula, Lipomyces. Многие дрожжи служат источниками для получения ферментных препаратов, которые используются в современной пищевой и химической промышленности. Из дрожжевого осадка, образующегося как отход пивоварения, получают фермент b-фруктофуранозидазу (инвертазу), расщепляющий сахарозу на глюкозу и фруктозу. Препараты инвертазы широко применяются в кондитерской промышленности для предотвращения кристаллизации сахарозы, для приготовления инвертных сиропов. С помощью культур Kluyveromyces marxianus получают b-галактозидазу, которая применяется в молочной промышленности. Дрожжи Yarrowia lipolytica используются для получения лииолитических ферментов, представляющих большой интерес для многих отраслей хозяйства. Липазы используются в сыроварении, в косметической промышленности, при выделке мехов и кож, в моющих средствах. В последние годы разработано множество способов получения самых различных ферментов из дрожжей: пектиназ из Saccharomycopsis fibidiger, амилаз из Schwanniomyces occidentalis, ксиланаз из Cryptococcus laurentii, гидролаз L-a-амино-e-капролактама из криптококков, алкогольоксидазы из Hyphopichia burtonii, оксидазы D-аминокислот из Trigonopsis variabilis, фенилаланинаммиаклиазы из ^ Rhodotorula glutinis. Применение дрожжей как источников витаминов началось в 1930-е гг. Одним из первых промышленных процессов получения витаминов было выделение эргостерина из Saccharomyces cerevisiae с последующим облучением ультрафиолетом для перевода в витамин D. Затем у дрожжей была открыта способность к сверхсинтезу некоторых витаминов группы В, в частности рибофлавина. Разработаны промышленные способы получения b-каротина из красных дрожжей. Кроме производства индивидуальных витаминов уже много лет в мире практикуется получение автолизатов и гидролизатов дрожжей, которые используются как источник витаминов и как вкусовые добавки.