 |
|
Порядок выполнения работы
Опыт №1. Влияние концентрации тиосульфаты натрия на скорость его разложения в кислой среде.

Табл. 1. Приготовление растворов.
| № пробирки | Число капель | |||
| Na2S2O3 | H2O | H2SO4 | Всего | |
| - |
Табл. 2. Результаты опыта.
| № пробирки | С(Na2S2O3) отн. ед. | lnCотн (Ci/C1) | Время реакции,τ, с | Скорость реакции, с-1 |
| 4,8 . 10-2 | ||||
| 0,693 | 14,3. 10-2 | |||
| 1,1 | 20 . 10-2 |
Найдем значения скорости реакции:



1. График зависимости скорости реакции
от концентрации тиосульфата натрия.

2. График зависимости логарифма
относительной концентрации от
времени протекания реакции.


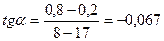
Na2S2O3 + H2SO4 ⇄ Na2SO4 + SO2 + H2O + S¯,
протекает в три стадии:
1. Na2S2O3 + H2SO4 = H2S2O3 +Na2SO4
2. H2S2O3 = H2SO3 + S ¯
3. H2SO3 = SO2 + H2O,
из которых реакции первой и третьей стадий идут практически мгновенно, а реакции второй стадии – медленно. Именно она и определит скорость суммарного процесса, т.е. будет зависеть только от концентрации тиосерной кислоты Н2S2O3, количество которой пропорционально количеству тиосульфата натрия Na2S2O3 при наличии избытка серной кислоты. Таким образом, кинетическое уравнение запишется:

Вывод: Закон действия масс в нашем опыте подтвердился. При постоянной температуре скорость химической реакции пропорциональна произведению концентрации реагирующих веществ, что видно из графика № 1 «График зависимости скорости реакции
от концентрации тиосульфата натрия».
Опыт №2. Влияние температуры на скорость реакции разложения тиосульфата натрия в кислой среде.
| № п/п | Температура, °С | Время, t, сек. |
Зависимость скорости реакции от температуры
| № п/п | Температура T, K | Время реакции t, сек. | Скорость реакции v = 1/τ, с−1 | g | Ea, кДж/моль | |
| 296,15 | 0,027 | 2,48 | 68,5 | |||
| 306,15 | 0,067 | |||||
| 3,37 | 97,4 | |||||
| 315,15 | 0,2 |
При обработке результатов эксперимента воспользуемся правилом Вант-Гоффа:
При увеличении температуры на 10 K скорость химических реакций возрастает в 2 – 4 раза
 ,
,
где γ – температурный коэффициент скорости реакции.
γ1= 0,067/ 0,027= 2,48
γ2=  =3,37
=3,37
γср= (2,48+3,37) /2= 2,925
Путем проведения опыта было подтверждено эмпирическое правило Вант-Гоффа, только с незначительной погрешностью.
Теперь вычислим энергию активации реакции:


где R = 8,31 Дж/моль.K, T – температура в K,  i = скорость химической реакции.
i = скорость химической реакции.
Вывод: Правило Вант-Гоффа в нашем опыте подтвердилось. Исходя из полученных значений температурного коэффициента (2,48; 3,75) мы можем сделать вывод : с повышением температуры скорость реакций увеличивается в 2-4 раза.
Опыт №5. Влияние концентраций реагентов на равновесие обратимой реакции между хлоридом железа (III) и тиоцианатом аммония.
FeCl3 + 3NH4CNS = Fe(CNS)3 + 3NH4Cl
Налили в химический стаканчик по 5 капель растворов хлорида железа (III) и тиоцианата аммония, перемешали и разлили в 4 пробирки.
I.Без добавок реакция прошла плавно и получился оранжевый раствор.
II.Здесь мы добавили FeCl3 (конц.), раствор окрасился в темно-оранжевый цвет; химическое равновесие сместилось вправо.
III.После добавления NH4CNS (конц.)раствор окрасился в темно-красный цвет; химическое равновесие сместилось вправо.
IV.Затем добавили NH4Cl,раствор окрасился в желтоватый цвет, а химическое равновесие сместилось влево.