 |
|
Цикл воздушной холодильной установки
Задача1

Газовая трехкомпонентная смесь, имеющая состав m1, m2, m3 (в кг), совершает в тепловом двигателе круговой процесс (цикл) по преобразованию теплоты в механическую работу. Ряд значений параметров состояния смеси в отдельных точках цикла задан таблично:
| Компонент смеси Масса компонента (кг) | Параметры состояния смеси (т.1, т.5) | |||||
| m1 | m2 | m3 | P1, бар | T1, К | P5, бар | T5, К |
| O2 2 | N2 5 | СО 3 | 1,9 | - |
| Параметры состояния смеси (т.2, т.3) | Параметры состояния смеси (т.4) | ||||
| P2, бар | T2, К | P3, бар | T3, К | Т4, К | v4, м3/кг |
| 8,1 | - | - | 2/3·v3+1/3·v5 |
В цикле предполагается, что:
1) процессы (2→3) и (5→1) – изохорные, (3→4) изобарный, (1→2) и (4→5) – политропные;
2) если по условиям варианта P2 = P3 или P5 = P1,то в цикле отсутствуют, соответственно, процессы (2→3) и (5→1);
3) при T = const политропный процесс превращается в изотермический (n = 1);
4) если по результатам расчетов n = k (показатель политропы равен показателю адиабаты), то политропный процесс рассчитывается как адиабатный (dq = 0).
Требуется:
1)Определить удельную газовую постоянную смеси и её «кажущуюся» молекулярную массу.
2)Определить коэффициент полезного действия цикла.
3)Определить коэффициент полезного действия цикла Карно в интервале температур цикла (от Тmax до Tmin).
4)Построить цикл в Pv- и Ts –диаграммах (с расчётом 2х – 3х промежуточных точек в каждом процессе).
Решение:
1.Масса смеси.
mCM = m1+ m2 + m3 = 2 + 5 + 3 = 10 кг.
2.Массовые доли газов, входящих в состав смеси.
g(O2) = m1/mCM = 2/10 = 0,2;
g(N2) = m2/mCM = 5/10 = 0,5;
g(CO) = m3/mCM = 3/10 = 0,3.
3. Объёмные доли газов, входящих в состав смеси:
rN2 = (gN2/μN2)/[ gN2/μN2+ gO2/μO2 + gСО/μСО)
rN2 = (0,5/28)/[ 0,5/28+ 0,2/32 + 0,3/28) = 0,513;
rO2 = (gO2/μO2)/[ gN2/μN2+ gO2/μO2 + gСО/μСО)
rO2 = (0,2/32)/[ 0,5/28+ 0,2/32 + 0,3/28) = 0,179;
rСО = 1- rN2– rO2 = 1 – 0,513 – 0,179 = 0,308
4.Молекулярная масса смеси.
μCM = 1/[ g(O2)/μ(O2) + g(N2)/μ(N2) + g(CO)/μ(CO)];
μCM = 1/[ 0,2/32 + 0,5/28 + 0,3/28] = 28,72.
μCM = rN2*μN2 + rО2*μО2 + rСО*μСО = 0,513*28 + 0,179*32 + 0,308*28 = 28,72.
5.Удельная газовая постоянная смеси.
RCM = 8314/μCM = 8314/28,72 = 289,5 Дж/(кг*К).
6. Определение параметров состояния газовой смеси (Р, v, Т) в характерных точках цикла и показателей политропы процессов, составляющих цикл.
Точка 1.
P1 = 0,19 МПа; Т1 = 340К;
Удельный объём смеси:
v1 = RСМ*T1/P1 = 289,5*340/(0,19*106) = 0,52 м3/кг.
Точка 2.
Р2 = 0,81 МПа; Т2 = 410 К;
Удельный объём смеси:
v2 = RСМ*T2/Р2 = 289,5*410/(0,81*106) = 0,15 м3/кг.
Точка 3.
Т3 = 550К
v2 = v3 = 0,15 м3/кг;
P3 = RСМ*T3/v3 = 289,5*550/0,15 = 1,06*106 Па
Точка 5.
v5 = v1 = 0,52 м3/кг; Т5 = 640К;
Р5 = RСМ*T5/v5 = 289,5*640/0,52 = 0,36*106 Па
Точка 4.
v4 = 2/3·v3+1/3·v5 = 2/3·0,15+1/3·0,52 = 0,22 м3/кг;
Р4 = Р3 = 1,06 МПа;
Т4 = Р4*v4/RСМ = 1,06*106*0,22/289,5 = 806K.
Результаты расчётов сведём в таблицу.
| Точка | Р, МПа | V, м3/кг | T,K |
| 0,19 | 0,52 | ||
| 0,81 | 0,15 | ||
| 1,06 | 0,15 | ||
| 1,06 | 0,22 | ||
| 0,36 | 0,52 |
Показатели политропы процессов.
1-2 – политропный процесс,
n1-2 = lg(P2/P1)/lg(v1/v2) = lg(0,81/0,19)/lg(0,52/0,15) = 1,17.
2-3- изохорный процесс, n2-3 = ∞;
3-4 – изобарный процесс, n3-4 = 0;
4-5 – политропный процесс,
n4-5 = lg(P5/P4)/lg(v4/v5) = lg(0,36/1,06)/lg(0,22/0,52) = 1,26;
5-1 - изохорный процесс, n5-1 = ∞.
7.Изохорная теплоёмкость смеси.
Сvсм =g(O2)*Сv(O2) + g(N2)*Сv(N2) + g(CO)*Сv(CO);
Сv(CO) = 20,93/28 = 0,748 кДж/(кг*К);
Сv(O2) = 20,93/32 = 0,654 кДж/(кг*К);
Сv(N2) = 20,93/28 = 0,748 кДж/(кг*К);
Сvсм = 0,3*0,748+0,2*0,654+0,5*0,748 = 0,729 кДж/(кг*К).
8. Изобарная теплоёмкость смеси.
Срсм = Сvсм + RСМ = 0,729+0,2895 = 1,0185 кДж/(кг*К).
9.Показатель адиабаты.
k = Срсм/ Сvсм = 1,0185/0,729 = 1,39.
10. Количество теплоты в процессах.
q1-2 =[Cv*(n1-2-k)/(n1-2-1)]*(T2 – T1) = [0,729*(1,17-1,39)/(1,17-1)]*(410-340)=
= -65,948 кДж/кг;
q2-3 =Cv*(T3 – T2) = 0,729*(550 - 410)= 102,06 кДж/кг;
q3-4 =Cр*(T4 – T3) = 1,0185*(806 - 550)=260,736кДж/кг;
q4-5 =[Cv*(n4-5-k)/(n4-5-1)]*(T5 – T4) = [0,729*(1,26-1,39)/(1,26-1)]*(640-806)=
= 60,507 кДж/кг;
q5-1 =Cv*(T1 – T5) = 0,729*(340 - 640)= - 218,7 кДж/кг;
11. Количество тепла q1, подводимое в цикле:
q1= 102,06 + 60,507 + 260,736 = 423,303 кДж/кг.
12. Количество тепла q2, отводимое в цикле:
q2= - 218,7 – 65,948 = - 284,648 кДж/кг.
13. Полезная работа цикла lц и его термический КПД ηt:
lц = q1 – q2 = 423,303 – 218,7 = 204,603 кДж/кг;
η = lц /q1 = 204,603/423,303 = 0,483.
14. Термический КПД цикла Карно (ηtK) в интервале температур цикла:
ηK = (T max - T min)/ T max = (806 – 340)/806 = 0,578.
15.Построение цикла в координатах р-V и T-S
Изменение энтропии в процессах цикла:
Ds = Cn·ln(Ткон/Тнач) (с учетом знака Ds).
s1=0;
∆s1-2 = Cn*ln(T2/T1)= [Cv*(n1-2-k)/(n1-2-1)]*ln(T2/T1)=
=[0,729*(1,17 - 1,39)/(1,17-1)]*ln(410/340) = -0,177 кДж/(кг*К);
s2 = s1 + ∆s1-2 = -0,177 кДж/(кг*К);
∆s2-3 = Cv*ln(T3/T2) = 0,729*ln(550/410) = 0,214 кДж/(кг*К);
s3 = s2 + ∆s2-3 = 0,037 кДж/(кг*К);
∆s3-4 = Cp*ln(T4/T3) = 1,0185*ln(806/550) = 0,389 кДж/(кг*К);
s4 = s3 + ∆s3-4 = 0,426 кДж/(кг*К);
∆s4-5 = [Cv*(n4-5-k)/(n4-5-1)]*ln(T5/T4)= [0,729*(1,26-1,39)/(1,26-1)]*ln(640/806) = 0,084 кДж/(кг*К);
s5 = s4 + ∆s4-5 = 0,51 кДж/(кг*К);
∆s5-1 = Cv*ln(T1/T5) = 0,729*ln(340/640) = -0,51 кДж/(кг*К);
s1 = s5 + ∆s5-1 = 0 кДж/(кг*К);
Расчёт промежуточных точек
| Процесс 1 - 2 Рi = Р1 * (v1/vi)n12 | |||||
| V, м3/кг | 0,52 | 0,40 | 0,30 | 0,20 | 0,15 |
| P, МПа | 0,19 | 0,26 | 0,36 | 0,58 | 0,81 |
| Процесс 4 - 5 Рi = Р4 * (v4/vi)n45 | |||||
| V, м3/кг | 0,22 | 0,25 | 0,35 | 0,45 | 0,52 |
| P, МПа | 1,06 | 0,80 | 0,60 | 0,43 | 0,36 |
| Процесс 1 - 2 ∆s1-i = Сn*ln(Ti/T1) | |||||
| T,К | |||||
| ∆s, кДж/(кг*К) | 0,00 | -0,126 | -0,154 | -0,172 | -0,177 |
| Процесс 2 - 3 ∆s2-i = Сv*ln(Ti/T2) | |||||
| T,К | |||||
| ∆s, кДж/(кг*К) | 0,00 | 0,14 | 0,18 | 0,21 | 0,214 |
| Процесс 3 - 4 ∆s3-i = Сp*ln(Ti/T3) | |||||
| T,К | |||||
| ∆s, кДж/(кг*К) | 0,00 | 0,09 | 0,19 | 0,28 | 0,389 |
| Процесс 4 - 5 ∆s4-i = Сn*ln(Ti/T4) | |||||
| T,К | |||||
| ∆s, кДж/(кг*К) | 0,00 | 0,028 | 0,046 | 0,063 | 0,084 |
| Процесс 5 - 1 ∆s5-i = Сv*ln(Ti/T5) | |||||
| T,К | |||||
| ∆s, кДж/(кг*К) | 0,00 | -0,03 | -0,16 | -0,4 | -0,51 |
 |































































Контрольные вопросы
1. Сформулируйте и запишите основные законы, которым подчиняется идеальная газовая смесь.
Закон Дальтона: давление смеси идеальных газов равно сумме парциальных давлений входящих в нее газов, т.е.

где 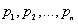 - парциальные давления - давления, которые бы оказывали компоненты смеси, если бы каждый из них занимал объем, равный объему смеси при той же температуре.
- парциальные давления - давления, которые бы оказывали компоненты смеси, если бы каждый из них занимал объем, равный объему смеси при той же температуре.
| Закон Амага: | ||
| Объем смеси идеальных газов равна сумме их парциальных объемов: | ||
| ||
| Уравнение Менделеева-Клайперона для смеси идеальных газов: | ||
| ||
| где Mmix - молярная масса (молекулярная масса, молекулярный вес) смеси: |
2. Напишите аналитическое выражение Первого закона термодинамики для каждого процесса рассчитанного Вами цикла.
В соответствии с первым законом термодинамики вся теплота, подведенная к телу, расходуется на изменение внутренней энергии тела и на совершение телом внешней работы: Q = L + ∆U.
Процесс 1→2– политропный: Q = L +∆U
Процесс 2→3– изохорный: Q = ∆U
Процесс 3→4– изобарный: Q = L +∆U
Процесс 4→5– политропный: Q = L +∆U
Процесс 5→1– изохорный: Q = ∆U
Задача 2
1 кг водяного пара с начальным давлением Р1 = 6,5 МПа и степенью сухости Х1 = 0,95 изотермически расширяется, при этом подводится теплота q = 470 кДж/кг.
Определить, пользуясь h-S – диаграммой, параметры конечного состояния пара, работу расширения, изменение внутренней энергии, энтальпии, энтропии. Решить также задачу, если расширение происходит изобарно. Изобразить процессы в Pv, Ts- u hs – диаграммах.
Решение:
Задачу решаем с помощью h-S – диаграммы.
 | |||
 | |||


 | |||
 | |||




Определяем начальное состояние пара на пересечении изобары Р1 = 6,5 МПа и линии постоянной сухости Х1 = 0,95. Параметры точки 1: температура t1 = 2950C, удельный объём ν1 = 0,03 м3/кг, удельная энтальпия h1 = 2700 кДж/кг, удельная энтропия s1 = 5,71 кДж/(кг*К).
Внутренняя энергия u1 = h1 – P1* ν1 = 2700 – 6,5*103*0,03 = 2505 кДж/кг.
1. Изотермическое расширение.
Тепло, подведённое к 1 кг пара в процессе изотермического расширения:
q = T*(s2 – s1),
отсюда энтропия в конце расширения:
s2 =s1 + q/T = 5,71 + 470/(295+273) = 6,54 кДж/(кг*К).
Определяем конечное состояние пара на пересечении изотермы t1 = 2950C и линии постоянной энтропии s2 = 6,54 кДж/(кг*К). Параметры состояния пара в точке 2: температура t2 = 2950C, удельный объём ν2 = 0,08 м3/кг, удельная энтальпия h2 = 3000 кДж/кг, удельная энтропия s2 = 6,54кДж/(кг*К), давление Р2 = 3 МПа.
Внутренняя энергия u2 = h2 – P2* ν2 = 3000 – 3*103*0,08 = 2760 кДж/кг.
 |  | ||||
 | |||||




 | |||
 | |||




Изменение внутренней энергии в процессе расширения:
∆u = u2 - u1 = 2760 - 2505 = 255 кДж/кг.
Работа расширения:
l = q - ∆u = 470 – 255 = 215 кДж/кг.
Изменение энтальпии:
∆h = h2 – h1 = 3000 – 2700 = 300 кДж/кг.
Изменение энтропии:
∆s = s2 – s1 = 6,54 - 5,71 = 0,83 кДж/(кг*К).
2. Изобарное расширение.
Тепло, подведённое к 1 кг пара в процессе изобарного расширения
q = h2 – h1,
тогда энтальпия в конце расширения
h2 = q + h1,
h2 = 470 + 2700 = 3170 кДж/кг
Определяем конечное состояние пара на пересечении изобары Р1 = 6,5МПа и линии постоянной энтальпии h2 = 3170 кДж/кг. Параметры состояния пара в точке 2: температура t2 = 4100C, удельный объём ν2 = 0,04 м3/кг, удельная энтальпия h2 = 3170 кДж/кг, удельная энтропия s2 = 6,52кДж/(кг*К), давление Р2 = 6,5 МПа.

 |  | ||








Внутренняя энергия u2 = h2 – P2* ν2 = 3170 – 6,5*103*0,04 = 2910 кДж/кг.
Изменение внутренней энергии в процессе расширения:
∆u = u2 - u1 = 2910 – 2505 = 405 кДж/кг.
Работа расширения:
l = Р*∆υ = Р*(υ2 – υ1) = 6,5*103*(0,04 – 0,03) = 65*103 Дж/кг.
Изменение энтальпии:
∆h = h2 – h1 = 470 кДж/кг.
Изменение энтропии:
∆s = s2 – s1 = 6,52 - 5,71 = 0,81 кДж/(кг*К).

Изображение изобарного процесса в рv, Тs - диаграммах

Изображение изотермического процесса в рv, Тs – диаграммах.
Контрольные вопросы
1. Дайте определение внутренней энергии реального и идеального газов. В чем отличие аналитической записи Первого закона термодинамики
для изотермического процесса в идеальных и реальных газах?
С точки зрения молекулярно-кинетической теории внутренняя энергия макроскопического тела равна сумме кинетических энергий беспорядочного движения всех молекул (или атомов) тела и потенциальных энергий взаимодействия всех молекул друг с другом (но не с молекулами других тел).
Так как молекулы идеального газа не взаимодействуют друг с другом, то их потенциальная энергия равна нулю. Вся внутренняя энергия идеального газа определяется кинетической энергией беспорядочного движения его молекул. Внутренняя энергия идеального газа зависит только от температуры, поэтому изменить внутреннюю энергию можно изменив температуру идеального газа.
Неидеальность газов в молекулярно-кинетической теории рассматривается как результат взаимодействия молекул.
Внутренняя энергия реального газа складывается из кинетической энергии теплового движения его молекул и из потенциальной энергии межмолекулярного взаимодействия. Внутренняя энергия реального газа зависит не только от его температуры, как в случае с идеальным газом, но и от объема, занимаемого им.
В изотермическом процессе температура газа не изменяется, следовательно, не изменяется и внутренняя энергия газа, ΔU = 0. Первый закон термодинамики для изотермического процесса идеального газа выражается соотношением Q = L.
В реальных газах при изотермических процессах не изменяется кинетическая энергия теплового движения молекул (ΔU = 0), но происходит изменение потенциальной энергии межмолекулярного взаимодействия(-a/V).
Первый закон термодинамики для изотермического процесса реального газа выражается соотношением Q = L – a/V.
2. В каком процессе (P = const или t = const) при заданных X1, P1 и q
работа будет больше и за счет чего?
В результате изотермического расширения пара происходит уменьшение давления, что влечёт за собой согласно уравнению ∆u = u2 - u1 = (h2 – P2* ν2) - (h1 – P1* ν1), уменьшение изменения внутренней энергии. А это в свою очередь, приводит к увеличению той части тепла, поступившего в систему, которая расходуется на совершение работы этой системой. При изобарном расширении изменение внутренней энергии будет больше, чем при изотермическом, следовательно работа будет больше при изотермическом расширении.
Задача 3
Расход газа(Не) в поршневом одноступенчатом компрессоре составляет V1 = 55 м3/мин при давлении Р1 = 0,1 МПа и температуре t1 = 220C. При сжатии температура газа повышается на 2000С. Сжатие происходит по политропе с показателем n = 1,5. Определить конечное давление, работу сжатия и работу привода компрессора, количество отведённой теплоты, а также теоретическую мощность привода компрессора.
Решение:
Определяем начальный удельный объём гелия:
Используем уравнение состояния:
P1*v1 = R*T1 → v1 = R*T1/P1 = 2078,5*295/(0,1*106) = 6,13 м3/кг,
где R = 2078,5 Дж/(кг*К) – газовая постоянная для гелия;
Т1 = t1 + 273 = 22+273 = 295К – абсолютная начальная температура азота.
Для определения давления в конце процесса используем уравнение:
(Р2) n-1/n = T2 *(P1 )n-1/n/T1,
Т2 =(t1 + 200)+273 = (22+200)+273 = 495К ;
(Р2) 1,5-1/1,5 = 495*(0,1*106)1,5-1/1,5/295 = 77,9,
Р2= 0,47*106Па.
Работа сжатия политропного процесса:
ln = [1/(n-1)]*P1*v1[(P2/P1)(n-1)/n -1],
ln = [1/(1,5-1)]*0,1*106*6,13*[(0,47/0,1)(1,5-1)/1,5 -1] = 827,6*103 Дж/кг.
Теоретическая работа привода компрессора:
l0 = [n/(n-1)]*P1*v1[(P2/P1)(n-1)/n -1],
l0 = [1,5/(1,5-1)]*0,1*106*6,13*[(0,47/0,1)(1,5-1)/1,5 -1] = 1241,4*103 Дж/кг.
Теоретическое количество отведённой теплоты:
q = Cv*[(n-k)/(n-1)]*(t2 – t1),
где Cv = 3,14 кДж/(кг*К) - массовая изохорная теплоёмкость гелия;
k = 1,67 – показатель адиабаты для одноатомного газа.
q = 3,14*[(1,5 – 1,67)/(1,5 - 1)]*200 = - 1,07 кДж/кг.
Массовый расход азота определяем из уравнения состояния:
М = Р1*V1/(R*T1),
где V1 – секундный расход газа,
V1 = 55/60 = 0,92 м3/с,
М = 0,1*106*0,92/(2078,5*295) = 0,15 кг/с.
Теоретическая мощность привода компрессора:
Nтеор = L0 = М* l0 = 0,15*1241,4 = 186,21*103 Вт.
Количество отведенной теплоты:
Q = M*q = 0,1*1070 = 107Вт.
Вопросы
1. Как влияет показатель политропы на конечное давление при выбранном давлении Р1 и фиксированных t1 и t2?
C увеличением показателя политропы конечное давление при выбранном давлении Р1 и фиксированных t1 и t2 увеличивается.
2. Чем ограничивается Р2 в реальном компрессоре?(кроме ограничения по максимально допустимой конечной температуре?).
Основной характеристикой компрессора является степень повышения давления П=р2/р1. Для одноступенчатого компрессора П=8-12. Величина П=р2/р1 для одноступенчатого компрессора ограничивается максимальной температурой в конце процесса сжатия Т2max  (3000C) из- за опасности возгорания масла и наличием вредного (мертвого) пространства между поршнем компрессора и днищем цилиндра из-за размещения в нем клапанов (всасывающего и нагнетательного), что учитывается объемным кпд компрессора
(3000C) из- за опасности возгорания масла и наличием вредного (мертвого) пространства между поршнем компрессора и днищем цилиндра из-за размещения в нем клапанов (всасывающего и нагнетательного), что учитывается объемным кпд компрессора 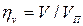 , где V – фактический объем всасываемого газа. Для реальных компрессоров
, где V – фактический объем всасываемого газа. Для реальных компрессоров  (всегда). Влияние вредного пространства на степень повышения давления в одноступенчатом компрессоре проиллюстрируем следующим рисунком:
(всегда). Влияние вредного пространства на степень повышения давления в одноступенчатом компрессоре проиллюстрируем следующим рисунком:

где процесс В1-А1 – это процесс расширения газа, оставшегося во вредном пространстве; т.А1 – фактическое начало всасывания газа. С ростом давления р2 объемный кпд компрессора  уменьшается и при
уменьшается и при  фактический объем всасываемого газа равен нулю (
фактический объем всасываемого газа равен нулю (  ) и
) и  .
.
Задача 4
Определить потребную поверхность рекуперативного теплообменника, в котором вода нагревается горячими газами. Расчёт произвести для прямоточной и противоточной схемы. Привести графики изменения температур для обеих схем движения. Значения температур газа
t1΄ = 4750C u t1΄΄ = 3250C, воды t2΄ = 150C u t2΄΄ = 1300C, расход воды М= 0,7 кг/с, коэффициент теплопередачи К = 44 Вт/(м2*К).
Решение:
Количество тепла, переданное горячими газами воде:
Q = М*C*( t2΄΄ – t2΄),
где М – расход воды, кг/с;
С – массовая теплоёмкость воды, С = 4,187 кДж/(кг*К);
t2΄ - температура воды на входе в теплообменник, 0С;
t2΄΄ - температура воды на выходе из теплообменника, 0С.
Q = 0,7*4,187*(130 – 15) = 337,054 кВт.
Для определения поверхности теплообменника используем уравнение теплопередачи:
Q = k*F*∆t → F = Q/(k*∆t),
где k - коэффициент теплопередачи;
F - площадь поверхности теплообмена;
∆tср - среднелогарифмический температурный напор.
Среднелогарифмический температурный напор для прямоточной схемы движения теплоносителей:
∆tср1 = [(t1΄ - t2΄ ) – (t1΄΄ - t2΄΄ )] / ln[(t1΄ - t2΄ )/(t1΄΄ - t2΄΄ )];
∆tср1 = [(475 - 15) – (325 - 130)] / ln[(475 - 15)/(325 - 130)] = 3090C.
Площадь поверхности теплообменника при прямоточной схеме движения теплоносителей:
F1 = Q /( k*∆tcp1) = 337054/(44*309) = 24,8 м2.
Средний температурный напор для противоточной схемы движения теплоносителей:
∆tср2 = [(t1΄ - t2΄’ ) – (t1΄΄ - t2΄ )] / ln[(t1΄ - t2’’ )/(t1΄΄ - t2΄)];
∆tср2 = [(475 - 130) – (325 - 15)] / ln[(475 - 130)/(325 - 15)] = 3270C.
Площадь поверхности теплообменника при противоточной схеме движения теплоносителей:
F2 = Q /( k*∆tcp2) = 337054/(44*327) = 23,4 м2.

 При противоточной схеме движения средний температурный напор больше, чем при прямоточной, поэтому противоточная схема движения теплоносителей имеет меньшую поверхность нагрева.
При противоточной схеме движения средний температурный напор больше, чем при прямоточной, поэтому противоточная схема движения теплоносителей имеет меньшую поверхность нагрева.
 |  | ||||
 |








 | |||||
 | |||||
 | |||||


 |  | ||||||
 |  | ||||||
График изменения температур теплоносителей:
а - противоток; б - прямоток
Контрольные вопросы
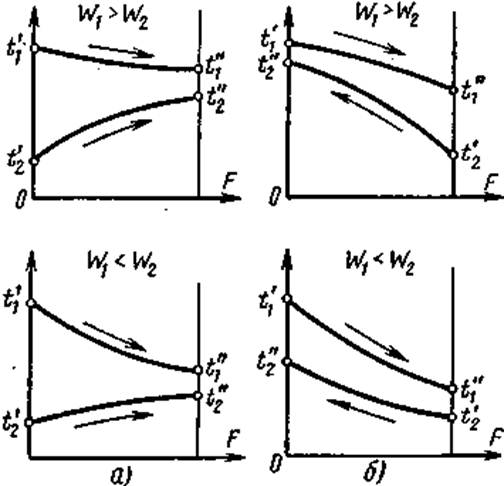
1. В каком случае изменение температуры греющего теплоносителя в теплообменнике больше, чем нагреваемого, и в каком меньше?
Характер изменения температуры рабочих жидкостей вдоль поверхности нагрева зависит от схемы их движения и соотношения величин W1 и W2.
В зависимости от того, осуществляется ли прямоток или противоток и W1больше или меньше, чем W3, получаются четыре характерные пары кривых изменения температуры вдоль поверхности нагрева, представленные на рис. 2. Здесь по осям абсцисс отложена площадь поверхности нагрева F, а по осям ординат — температура рабочих жидкостей.
|
В соответствии с уравнением

на графиках большее изменение температуры t'—t" = δt получается для той жидкости, у которой значение величины W меньше.
Таким образом, при W1<W2 при прямотоке и противотоке изменение температуры греющего теплоносителя больше, чем нагреваемого, при W1>W2 – наоборот.
2. На каких основных уравнениях базируется тепловой расчет теплообменных аппаратов? В чем сущность проектного и поверочного тепловых расчетов?
Тепловой расчёт теплообменных аппаратов базируется на двух уравнениях: уравнения теплового баланса и теплопередачи.
Уравнение теплопередачи: Q=КF  ср
ср
уравнение теплового баланса с однофазными тепло- и хладоносителями: Q- Q окр= Glcp1(t/1 – t//1) = G2cp2(t//2 – t/2)
где Q - количество тепла отданное горячим и принятое холодным теплоносителем, Вт; К - средний для всей поверхности теплообменника коэффициент теплопередачи, Вт/(м2·К);  - средний температурный напор между теплоносителями в теплообменнике, К; F - площадь теплопередающей поверхности теплообменника, м2; Вт; Qокр -потери тепла в окружающую среду, Вт; t/1, t//1 и t/2, t//2 - температура горячего и холодного теплоносителя на входе и выходе из теплообменника.
- средний температурный напор между теплоносителями в теплообменнике, К; F - площадь теплопередающей поверхности теплообменника, м2; Вт; Qокр -потери тепла в окружающую среду, Вт; t/1, t//1 и t/2, t//2 - температура горячего и холодного теплоносителя на входе и выходе из теплообменника.
Пар – пар: Q=G1(h/1 – h//1)=G2(h//2 – h/2)
где h/1 , h//1 - энтальпия горячего теплоносителя на входе и выходе из теплообменника; h//2 ,h/2 - энтальпия холодного теплоносителя на входе и выходе из теплообменника.
Различают проектный и поверочный тепловой расчет теплообменного аппарата. Цель проектного расчета состоит в определении величины рабочей поверхности теплообменник;! которая является исходным параметром при его проектировании. При этом должно быть известно количество передаваемой теплоты или массовые расходы теплоносителей и изменение их температуры.
Поверочный расчет выполняется для теплообменника с известной величиной поверхности. Цель расчета состоит в определении температур теплоносителя на выходе из теплообменника и количества передаваемой теплоты
Задача 5
Определить часовой расход пара D (килограммов в час) и удельный расход пара d (килограммов на киловатт-час) на конденсационную паровую турбину, работающую без регенерации теплоты, по заданной электрической мощности турбогенератора Nэл = 130 МВт давлению р1= 14 МПа и температуре t1= 5600С перегретого пара перед турбиной и относительному внутреннему КПД турбины ηoi = 0,82. Давление пара в конденсаторе принять р2 = 4 кПа. Механический КПД турбины ηм и КПД электрогенератора ηэ принять ηм = ηэ = 0,99. Определить также степень сухости пара в конце теоретического и действительного процессов расширения (изобразив процессы в hs- диаграмме) и абсолютный электрический КПД турбогенератора. Мощностью привода питательного насоса пренебречь.
Решение:
Задачу решаем при помощи h-s диаграммы.
 | |||
 | |||






 | |||
 | |||
Начальное состояние – точка 1 – на пересечении изобары Р1 = 14 МПа и изотермы t1 = 5600C. Энтальпия в этой точке h1 = 3430кДж/кг, энтропия S1 = 6,52 кДж/(кг*К).
Точка 2 – на пересечении адиабаты S2 =S1 =6,52 кДж/(кг*К) и изобары
Р2 = 0,004 МПа. Энтальпия в этой точке h2 = 1975 кДж/кг, степень сухости х2 = 0,76.
Располагаемый теплоперепад в турбине:
h₀=h1 -  = 3430 – 1975 = 1455 кДж/кг.
= 3430 – 1975 = 1455 кДж/кг.
Удельный расход пара:
d= 3600/( η0i* h₀) = 3600/(0,82*1455) = 3,1 кг/(кВт*ч).
Параметры пара, отвечающие действительному циклу, находятся в точке 2' (пересечение линий h2’ = h1 - ηoi*hо = 3430 – 0,82* 1455 = 2237 кДж/кг и изобары P2 = 0,004 МПа ). Для этого состояния определяем: х2’ = 0,89.
Часовой расход пара:
Д = d* Nэл / ηэ = 3,1*130*103 /0,99*0,99 = 411183 кг/ч.
Абсолютный электрический КПД турбогенератора:
ηэл = Nэл *3600/(Д*( h1 – h2’)) = 130*103*3600/(411183*(3430 – 2237)) = 0,954.
Термический КПД цикла Ренкина:
ηt = (h1 – h2)/(h1 – h3) = (3430 – 1975)/(3430 – 121) = 0,44.
h3 = 121 кДж/кг – энтальпия конденсата при Р2 = 4 кПа.
Контрольные вопросы
1. Изобразить схему паросиловой установки и дать её краткое описание.
Схема паротурбинной установки
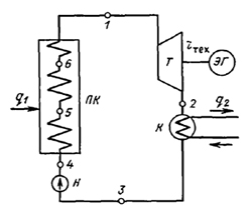
ПК — паровой котел; Т — паровая турбина; ЭГ- электрогенератор;
К — конденсатор; Н — насос
2. Как влияют начальные и конечные параметры пара на работу и кпд цикла Ренкина, а также на степень сухости пара в конце расширения (X2)? Указать, каковы минимально допустимые значения X2 и почему?
Влияние основных параметров пара на величину кпд цикла Ренкина
Если повышать начальное давление в паровом котле от р1"′ до р1′ при постоянной температуре перегрева t1 и при постоянном давлении р2 в конденсаторе, то возрастает разность энтальпий Dh = h1 – h2, то есть возрастает термический к.п.д. Вместе с тем с повышением начального давления уменьшается степень сухости пара на выходе из турбины. Уменьшение конечной степени сухости ведет к разрушению лопаток последних ступеней турбины. Предельная степень сухости пара должна быть не ниже 0,86.
При повышении температуры перегрева пара от t1′ до t1′" (при постоянных начальном р1 и конечном р2 давлениях) используемый в турбине перепад энтальпий Dh = h1 - h2 (или работа цикла lц) возрастает. Следовательно, возрастает и термический к.п.д. цикла, причем в этом случае увеличивается и конечная степень сухости пара (х), что улучшает условия работы турбины. Понижение конечного давления пара р2 ведет к увеличению работы lц цикла при неизменной энтальпии h1 и, следовательно, к повышению термического к.п.д.

| 
|
Влияние давления (a) и температуры (б) пара на к.п.д. цикла Ренкина
Задача 6
Паровая компрессорная установка с дроссельным вентилем использует пары низкокипящих жидкостей. Компрессор всасывает влажный насыщенный пар NH3 степенью сухости X1 и сжимает его адиабатно, превращая в сухой насыщенный пар при давлении, соответствующем температуре насыщения (конденсации) t2 = t3 = 200С. Из компрессора пар хладагента поступает в конденсатор, где он превращается в жидкость, которая затем проходит через дроссельный вентиль, вследствие чего жидкость частично испаряется, а температура понижается до t4 = t1 = -150С. При этой температуре хладагент поступает в охлаждаемое помещение(рефрижератор), где воспринимает тепло, испаряется, образуя влажный насыщенный пар со степенью сухости X1, и снова направляется в компрессор. Q0 = 250 кВт.
Определить
1. Удельную холодопроизводительность q хол (кДж/кг).
2. Часовой расход хладагента G (кг/с)
3. Теоретическую мощность компрессора NK (KBT).
4. Тепло, отданное в конденсаторе, q (кДж/кг).
5. Холодильный коэффициент ε.
6. Холодильный коэффициент цикла Карно в интервале температур данного цикла, εк.
Решение:
Схема холодильной установки.

1- дроссельный вентиль; 2- холодильник – испаритель; 3- компрессор;
4- теплообменник – конденсатор.
Изображение цикла в T,s – диаграмме.

Определяем для хладона NH3:
при t1 = -15 oC: h1′ = 350 кДж/кг, h1″ = 1662,6 кДж/кг, s1’ = 3,929 кДж/(кг·К); s1’’ = 9,015 кДж/(кг·К);
при t2 = 20 oC: h2′ = 512,5 кДж/кг; h2’’ = 1699,4 кДж/кг, s2’ = 4,516 кДж/(кг·К); s2’’ = 8,566 кДж/(кг·К);
Сухость пара в точке1:

Сухость пара в точке4:
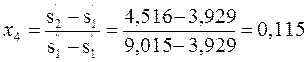
Определяем удельную холодопроизводительность установки:
qo = r1(x1 – x4) = (h1’’ – h1’)*(x1 – x4) = (1662,6 – 350)*(0,912 – 0,115) = 1026кДж/кг
Массовый расход хладона:
G = Qо/ qo = 250/1026= 0,24 кг/с.
Количество теплоты, отводимое с охлаждающей водой:
q = (h2’’ – h3’) = 1699,4 – 512,5 = 1186,9 кДж/кг;
h3’ = 512,5 кДж/кг при t3 = 200C u x3 = 0.
Работа сжатия:
ℓ0 = q - qo = 1186,9 - 1026 = 160,9 кДж/кг.
Холодильный коэффициент:
ε = qo/ ℓ0 = 1026/160,9 = 6,38.
Теоретическая мощность привода компрессора:
Nтеор = G* ℓ0 = 0,24*160,9 = 38,616 кВт.
Холодильный коэффициент цикла Карно в интервале температур данного цикла:
εK = T2/ (T1 – T2) = 258/(293 – 258) = 7,37.
Контрольные вопросы
1. Назовите типы существующих холодильных установок и способы передачи в них теплоты с более низкого температурного уровня на более высокий температурный уровень.
Охлаждение тел до температуры ниже температуры окружающей среды осуществляется с помощью холодильных установок, работающих по обратному тепловому циклу.
Холодильные установки по виду хладагентов делятся на две основные группы:
1)газовые (в частности, воздушные) холодильные установки, в которых хладагент — воздух — находится в состоянии, далеком от линии насыщения;
2)паровые холодильные установки, в которых в качестве хладагентов используются пары различных веществ.
Паровые холодильные установки подразделяются на парокомпрессионные, пароэжекторные и абсорбционные.
Отдельную группу составляют термоэлектрические холодильные установки. В холодильных установках этого типа хладагент отсутствует. (Холодильные установки, работающие при температурах ниже 120 К, принято называть криогенными установками.)
Рассмотрим циклы холодильных установок основных типов.
Цикл воздушной холодильной установки
Воздушная холодильная установка была одним из первых типов холодильных установок, примененных на практике.
Схема воздушной холодильной установки представлена на рис.1. Хладагент (воздух) расширяется в детандере 1 от давления p1 до давления р2, совершая работу, отдаваемую детандером внешнему потребителю (например, производя электроэнергию с помощью соединенного с детандером электрогенератора).
Воздух, охлажденный в результате процесса адиабатного расширения в детандере от температуры Т1 до температуры Т2, поступает в охлаждаемый объем 2, из которого он отбирает теплоту. Процесс передачи теплоты от охлаждаемого объема воздуху происходит при постоянном давлении воздуха (р2=const). Отвод теплоты из охлаждаемого объема возможен только в том случае, если температура воздуха в течение всего изобарного процесса отбора теплоты будет меньше, чем температура охлаждаемого объема. В принципе температура воздуха на выходе из охлаждаемого объема Т3 может сравняться с температурой охлаждаемых тел; на практике же она всегда немного ниже этой температуры.

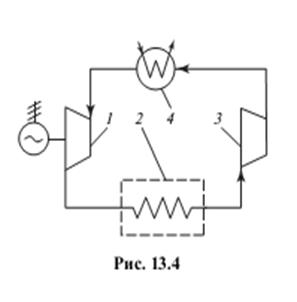
По выходе из охлаждаемого объема воздух направляется в компрессор3) 3, где его давление повышается от р2 до p1 (при этом температура воздуха возрастает от Т3 до T4 ). Сжатый компрессором воздух поступает в охладитель 4. Охладитель представляет собой теплообменник поверхностного типа, в котором температура воздуха снижается вследствие отдачи теплоты охлаждающей воде, циркулирующей через охладитель. В принципе температура воздуха на выходе из охладителя Т1 может быть сделана сколь угодно близкой к температуре охлаждающей воды, однако на практике температура воздуха всегда несколько выше температуры охлаждающей воды. Процесс в охладителе происходит при постоянном давлении воздуха (p1=const).

